Полярными (р > O) будут:
а) двухатомныемолекулы сложныхвеществ, так как они содержат только полярные связи;
б) многоатомныемолекулы сложныхвеществ, если их строение асимметрично, т. е. их геометрическая форма либо незавершенная, либо искаженная, что приводит к появлению суммарного электрического диполя, например у молекул NH 3, Н 2О, HNО 3и HCN.
Сложные ионы, например NH 4 +, SO 4 2-и NO 3 -, не могут быть диполями в принципе, они несут только один (положительный или отрицательный) заряд.
Ионная связь возникает при электростатическом притяжении катионов и анионов почти без обобществления пары электронов, например между К +и I -. У атома калия – недостаток электронной плотности, у атома иода – избыток. Такую связь считают предельнымслучаем ковалентной связи, поскольку пара электронов находится практически во владении у аниона. Такая связь наиболее характерна для соединений типичных металлов и неметаллов (CsF, NaBr, CaO, K 2S, Li 3N) и веществ класса солей (NaNО 3, K 2SО 4, СаСО 3). Все эти соединения при комнатных условиях представляют собой кристаллические вещества, которые объединяют общим названием ионные кристаллы (кристаллы, построенные из катионов и анионов).
Известен еще один вид связи, называемой металлической связью, в которой валентные электроны так непрочно удерживаются атомами металлов, что фактически не принадлежат конкретным атомам.
Атомы металлов, оставшиеся без четко принадлежащих им внешних электронов, становятся как бы положительными ионами. Они образуют металлическую кристаллическую решетку. Совокупность обобществленных валентных электронов ( электронный газ) удерживает положительные ионы металла вместе и в определенных узлах решетки.
Помимо ионных и металлических кристаллов существуют еще атомные и молекулярные кристаллические вещества, в узлах решеток которых находятся атомы или молекулы соответственно. Примеры: алмаз и графит – кристаллы с атомной решеткой, иод I 2и диоксид углерода СO 2(сухой лед) – кристаллы с молекулярной решеткой.
Химические связи существуют не только внутри молекул веществ, но могут образовываться и между молекулами, например для жидкого HF, воды Н 2O и смеси H 2O + NH 3:
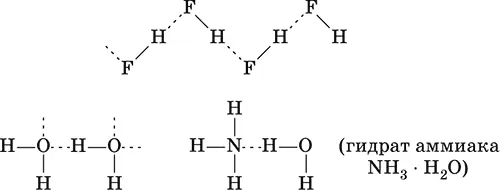
Водородная связь образуется за счет сил электростатического притяжения полярных молекул, содержащих атомы самых электроотрицательных элементов – F, О, N. Например, водородные связи имеются в HF, Н 2O и NH 3, но их нет в HCl, H 2S и РН 3.
Водородные связи малоустойчивы и разрываются довольно легко, например при плавлении льда и кипении воды. Однако на разрыв этих связей затрачивается некоторая дополнительная энергия, и поэтому температуры плавления (табл. 5) и кипения веществ с водородными связями
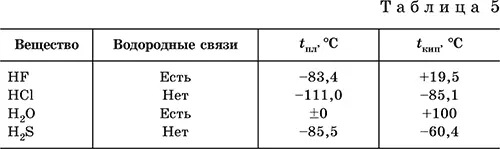
(например, HF и Н 2O) оказываются значительно выше, чем у подобных веществ, но без водородных связей (например, HCl и H 2S соответственно).
Многие органические соединения также образуют водородные связи; важную роль водородная связь играет в биологических процессах.
Примеры заданий части А
1. Вещества только с ковалентными связями – это
1) SiH 4, Сl 2O, СаВr 2
2) NF 3, NH 4Cl, P 2O 5
3) CH 4, HNO 3, Na(CH 3O)
4) CCl 2O, I 2, N 2O
2–4.Ковалентная связь
2. одинарная
3. двойная
4. тройная
присутствует в веществе
1) КСl
2) N 2
3) S 2
4) H 2S
5. Кратные связи имеются в молекулах
1) HCOOH
2) ССl 4
3) С 3Н 8
4) С 3Н 4
6. Частицы, называемые радикалами, – это
1) SO 2
2) СlO 2
3) С 2Н 6
4) С 2Н 5
7. Одна из связей образована по донорно-акцепторному механизму в наборе ионов
1) SO 4 2-, NH 4 +
2) H 3O +, NH 4 +
3) PO 4 3-, NO 3 -
4) PH 4 +, SO 3 2-
8. Наиболее прочнаяи короткаясвязь – в молекуле
1) Н 2O
2) H 2S
3) HF
4) PH 3
9. Вещества только с ионными связями – в наборе
1) HCl, КСl
2) NH 4Cl, SiCl 4
3) NaF, CsCl
4) Nal, P 2O 5
10–13.Кристаллическая решетка вещества
10. Si
11. H 2SO 4
12. Cr
13. Ва(ОН) 2
1) металлическая
2) ионная
3) атомная
4) молекулярная
4. Классификация и взаимосвязь неорганических веществ
Классификация неорганических веществ базируется на химическом составе – наиболее простой и постоянной во времени характеристике. Химический состав вещества показывает, какие элементы присутствуют в нем и в каком числовом отношении для их атомов.
Читать дальше
Конец ознакомительного отрывка
Купить книгу














