Чистый углерод также обладает удивительными свойствами, о которых и не подозревал Примо Леви, когда писал эти строки в 1970 году. До недавнего времени (скажем, 1990 год) учебники говорили о существовании двух кристаллических модификаций углерода – довольно распространенного графита и алмаза.
Алмаз – редко встречающийся кристалл, крупные образцы которого может создавать только природа при экстремальных температурах и давлениях. И все же химически алмаз являет собой самую простую модификацию углерода (илл. 2): в ней каждый атом имеет четырех соседей, с которыми образует очень прочные химические связи, называемые ковалентными (см. главу 16, «Микроволновая печь»). Стремление атома углерода иметь четырех соседей – результат довольно простых законов химии. Действительно, в атоме углерода, шестого элемента периодической таблицы, имеется шесть электронов. В упрощенной модели электроны распределяются вокруг ядра по оболочкам. Два ближайших к ядру электрона образуют «замкнутую оболочку»: они химически инертны. Остальные четыре электрона находятся на второй, более удаленной от ядра оболочке. Однако на ней хватило бы места и для восьми электронов, а атомы, как правило, стремятся иметь такую электронную структуру, чтобы их внешняя оболочка была заполненной. Это найденное химиками древности «правило октета» (или, для самых легких элементов, «правило дуэта») – закон, который современные ученые объясняют с помощью квантовой механики. Ради его соблюдения атомы готовы получать или терять электроны, образуя ионы, или делить электроны с другими атомами, создавая ковалентные связи.
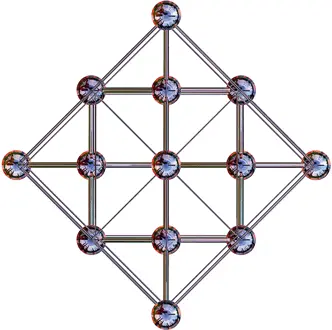
2. Кристаллическая структура алмаза. Кристаллическая решетка представляет собой гранецентрированную кубическую решетку (см. главу 9, «Кристаллы и стереометрия»), в которую включены четыре дополнительных атома углерода. Каждый атом окружен четырьмя соседями, которые образуют правильный тетраэдр
Семейная история
В конце XIX века российский химик Дмитрий Менделеев придумал систему классификации химических элементов. Он составил таблицу, в которой расположил их по степени возрастания атомной массы так, что элементы в каждом столбце обладают сходными химическими свойствами. Так, в столбце, соответствующем углероду, под ним находятся кремний (Si) и германий (Ge). Как и атом углерода, атомы этих элементов имеют на внешней оболочке по четыре электрона, которые готовы к участию в химических связях. Таким образом, кремний и германий также образуют кристаллы, имеющие структуру алмаза (илл. 2). Эти кристаллы широко используются в электронике: при добавлении определенных примесей они становятся полупроводниками (см. главу 28).
В алмазе каждый из четырех электронов внешней оболочки соединяется с электроном внешней оболочки другого атома с образованием четырех связей C–C, и, таким образом, правило октета оказывается соблюденным. Итак, каждый атом в алмазе имеет четыре соседних (см. врезку). Полученная таким образом структура оказывается невероятно прочной, и поэтому алмаз является очень твердым веществом.
Как мы уже упоминали, алмаз – редкая модификация углерода. По прихоти химии атомы углерода более склонны образовывать двумерную структуру, в которой каждый из них связывается только с тремя другими. Таков двумерный кристалл – графен (илл. 3). Оставшийся незадействованным четвертый электрон внешней оболочки (один на атом) готов участвовать в формировании слабой связи, которая соединяет между один слой графена с другим, другой с третьим и т. д. В результате такой упаковки формируется графит – наиболее распространенная форма кристаллического углерода (илл. 4). Это твердое темное вещество может служить, например, в качестве грифеля в обычном карандаше.

3. Графен состоит из атомов углерода, образующих решетку в виде сот
Соединяющие между собой слои графита слабые связи оказываются непрочными, и их довольно легко разорвать. Например, наклеивая на графит скотч и отрывая его, легко несколько слоев отделить; повторив такую процедуру несколько раз, в конце концов можно получить и единичный слой графена. Этот простой и успешный, нашедший широкое применение метод принес в 2010 году Нобелевскую премию по физике Андре Гейму и Константину Новоселову.
Читать дальше
Конец ознакомительного отрывка
Купить книгу






![Лина Сайфер - Театр мыльных пузырей [litres]](/books/434478/lina-sajfer-teatr-mylnyh-puzyrej-litres-thumb.webp)






