Задача 9
Как, по вашему мнению, изменится скорость звука в воздухе при изменении давления и постоянной температуре? (Ответьте на этот вопрос, учтя, что 28,8 кг воздуха при комнатной температуре и давлении 1 атм занимают 24 м 3, а при давлении 2 атм — 12 м 3.)
Диффузия
Если скорости молекул разных газов столь отличны, то при прохождении через длинную тонкую трубку один газ должен отделяться от другого. Для этого трубочки должны быть настолько длинными и узкими, чтобы молекулы газа просачивались через них поодиночке.
Опыт 4.Подходящими порами обладает, например, неглазурованная керамика (фиг. 13 и 14). Именно такими порами пронизана белая керамическая кружка J . Если наполнить ее сжатым газом и закрыть пробкой S , то, как и следовало ожидать, газ через поры постепенно вытечет из кружки в атмосферу. Но если внутри и снаружи давление одинаково (атмосферное), то трудно ожидать утечки, даже если внутри и снаружи были разные газы. Однако изменения происходят, указывая на разные скорости молекул. Описанный опыт начинается с того, что внутри кружки находится воздух, а вне ее — другой газ, также при атмосферном давлении. Молекулы водорода проникают в кружку быстрое, чем оттуда выходит воздух, или же воздух выходит быстрее, чем «вползают» молекулы СО 2. Это качественная демонстрация диффузии, но она подсказывает способ разделения смеси газов. Поместите внутрь кружки смесь водорода и СО 2. Тогда водород независимо от того, что находится вне кружки — воздух или вакуум, будет диффундировать быстрее, чем СО 2, так что, повторяя этот процесс несколько раз, можно получить почти чистый водород.
Фиг. 13. Диффузия газов.
Водород диффундирует внутрь сосуда сквозь пористую стенку J быстрее , чем воздух из него
Фиг. 14. Диффузия газов.
Углекислый газ диффундирует внутрь сосуда через пористую стенку J медленнее , чем воздух из него
В этом и состоит физический метод разделения, основанный на различии молекулярных скоростей, которое обусловлено различием масс молекул (фиг. 15). Здесь не требуется различия химических свойств, и им можно пользоваться для разделения «изотопов» — близнецов, которые совершенно идентичны химически, но немного отличаются атомным весом. Когда впервые были открыты изотопы — один образец газообразного неона оказался на 10 % плотнее другого, а одни атомы свинца тяжелее других, — это казалось любопытным курьезом. Разделение имело смысл с точки зрения демонстрации эффекта. Диффузия естественной смеси неона в атмосфере давала такую возможность. Ню после того как стало известно, что в природном уране перемешаны два изотопа, один из которых легко расщепляется, а другой нет, выделение редкого изотопа стало вопросом первостепенной важности. Сейчас для этого в огромных масштабах используют диффузию газов (см. задачу 11 и фиг.16–18; см. также гл. 30 и 43 [137].
Фиг. 15. Диффузия газов.
Воздух и углекислый газ при атмосферном давлении разделяются пористой перегородкой. Сначала они занимали равные объемы при одинаковом давлении и содержали одинаковое число молекул ( а). Но молекулы воздуха в среднем проходят по порам быстрее, чем молекулы СО2. Поэтому число молекул и давление становятся неодинаковыми ( б).
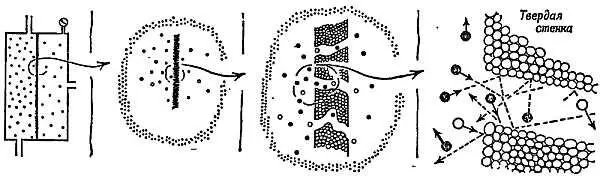
Фиг. 16. Разделение изотопов урана с помощью диффузии UF 6через пористую перегородку.
Молекулы газа, много раз соударяясь, с перегородкой и стенками пор, частично проникают сквозь них.
Фиг. 17. Разделение изотопов урана с помощью диффузии UF 6через пористую перегородку ( а) и многоступенчатое разделение диффузией ( б).
Смесь, прошедшая первую ступень, перекачивается на вход второй ступени. Неиспользованная смесь перекачивается назад на вход предыдущей ступени
Фиг. 18. Разделение изотопов урана с помощью диффузии.
Чтобы добиться почти полного отделения U 235 F6, необходимы тысячи ступеней
Температура
Нагревание газа увеличивает р или V . С увеличением температуры всегда возрастает pV , а поэтому и 1/ 3 Nmv ¯ 2. Следовательно, нагревание газа увеличивает v 2и заставляет молекулы двигаться быстрее. В этом суть эффекта повышения температуры.
Читать дальше









![Йэн Стюарт - Математика космоса [Как современная наука расшифровывает Вселенную]](/books/429584/jen-styuart-matematika-kosmosa-kak-sovremennaya-nau-thumb.webp)



