Рис. 2.14
В настоящее время известно строение многих сотен кристаллов. Расскажем про строение простейших кристаллов и прежде всего тех, которые построены из атомов одного сорта.
Наиболее распространены три типа решеток. Они показаны на рис. 2.15. Точками изображены центры атомов; линии, объединяющие точки, не имеют реального смысла. Они проведены лишь для того, чтобы сделать читателю более ясным характер пространственного расположения атомов.
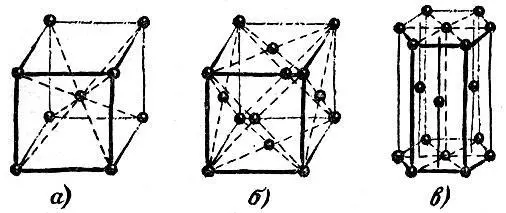
Рис. 2.15
Рис. 2.15, а и 2.15, б изображают кубические решетки. Чтобы представить себе эти решетки яснее, вообразите, что вы сложили простейшим способом - ребро к ребру, грань к грани -- детские кубики. Если теперь мысленно разместить точки по вершинам и центрам объемов кубов, то возникнет кубическая решетка, изображенная на левом рисунке. Такая структура называется кубической объемно-центрированной. Если разместить точки по вершинам кубов и в центрах их граней, то возникнет кубическая решетка, изображенная на среднем рисунке. Она называется кубической гранецентрированной.
Третья решетка (рис. 2.15, в ) называется плотней-шей гексагональной (т. е. шестиугольной). Чтобы понять происхождение этого термина и яснее представить себе расположение атомов в этой решетке, возьмем биллиардные шары и начнем укладывать их как можно плотнее. Прежде всего составим плотный слой - он выглядит так, как биллиардные шары, собранные "треугольником" перед началом игры (рис. 2.16). Отметим, что шар внутри треугольника имеет шесть соприкасающихся с ним соседей, и эти шесть соседей образуют шестиугольник. Продолжим укладку наложением слоев друг на друга. Если поместить шары следующего слоя непосредственно над шарами первого слоя, то такая упаковка была бы неплотной. Стараясь разместить в определенном объеме наибольшее число шаров, мы должны положить шары второго слоя в лунки первого, третьего слоя - в лунки второго и т. д. В гексагональной плотнейшей упаковке шары третьего слоя размещены так, что центры этих шаров лежат над центрами шаров первого слоя.
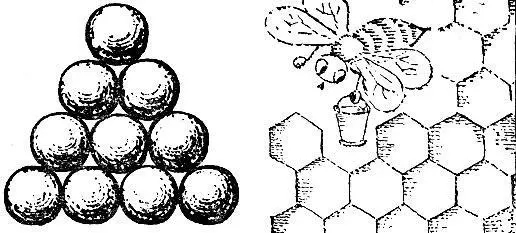
Рис. 2.16
Центры атомов в гексагональной плотнейшей решетке расположены так, как центры шаров, плотно уложенных описанным способом.
В описанных трех решетках кристаллизуется множество элементов:
Гексагональная плотнейшая упаковка..... Be, Co, Hf, Ti, Zn, Zr
Кубическая гранецентрированная......... А1, Си, Со, Fe, Au, Ge, Ni, Ti
Кубическая объемно-центрированная........ Cr, Fe, Li, Mo, Ta§ Ti, U, V
Из других структур упомянем лишь немногие. На рис. 2.17 изображена структура алмаза. Для этой структуры характерно то, что атом углерода алмаза имеет четыре ближайших соседа. Сопоставим это число с соответствующими числами описанных только что трех наиболее распространенных структур. Как видно из рисунков, в плотнейшей гексагональной упаковке у каждого атома 12 ближайших соседей, столько же соседей у атомов, образующих гранецентрированную кубическую решетку; в объемно-центрированной решетке у каждого атома 8 соседей.
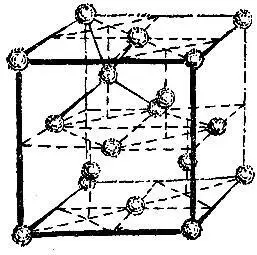
Рис. 2.17
Несколько слов скажем о графите, строение которого показано на рис. 2.18. Особенность этой структуры бросается в глаза. Графит состоит из слоев атомов, причем атомы одного слоя связаны между собой сильнее, чем атомы соседних слоев. Это связано с величиной межатомных расстояний: расстояние между соседями в одном слое в 2,5 раза меньше кратчайшего расстояния между слоями.
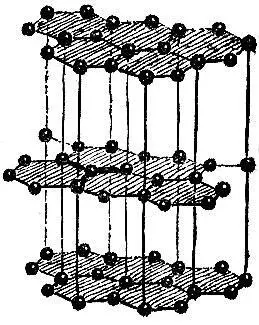
Рис. 2.18
Наличие слабо связанных атомных слоев приводит к тому, что кристаллы графита легко расщепляются вдоль этих слоев. Поэтому твердый графит может служить смазочным материалом в тех случаях, когда невозможно применять смазочные масла,- например, при очень низких или очень высоких температурах. Графит - твердый смазочный материал.
Трение между двумя телами сводится, грубо говоря, к тому, что микроскопические выступы одного тела западают во впадины другого. Усилие, достаточное для того, чтобы расщепить микроскопический графитовый кристаллик, много меньше сил трении, поэтому наличие графитовой смазки значительно облегчает скольжение одного тела по другому.
Читать дальше