Эти два физика задумали остроумный эксперимент, в котором, по их замыслу, можно было определить энергию ионизации атома, т.е. величину той энергии, которую нужно сообщить атому, чтобы освободить его внешние электроны. Сущность эксперимента заключалась в том, чтобы возбуждать атомы ударами электронов, а затем, измеряя энергию, которую электроны теряют при столкновениях, вычислять измененную энергию. Они обнаружили, что получаются последовательные изменения энергии, как показано на рис. 27, где минимумы тока, зарегистрированные при увеличении энергии электрона, соответствуют энергии, которая передается от электронов атомам. Бор дал правильную интерпретацию этим значениям. Они определяют «энергии ионизации», которые в его интерпретации соответствуют энергиям разных возможных орбит электронов в атоме. Таким образом, энергия атома не изменяется электроном, чья энергия недостаточна, чтобы «ионизовать» его, и орбиты электронов в атоме могут иметь вполне определенные значения энергии. Эксперименты Франка и Герца и их интерпретация Бором убедительно продемонстрировали не только существование стационарных состояний, которые постулировались Бором, но также возможность возбуждать их ударами электронов, причем скачки между ними подчиняются фундаментальным законам, выдвинутым Бором.
За эту работу Франк и Герц получили Нобелевскую премию по физике в 1925 г.
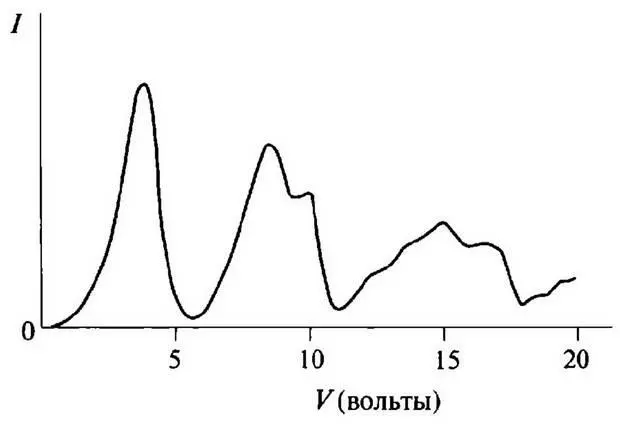
Рис. 27. Результат эксперимента Франка и Герца с парами ртути. На графике показана зависимость тока от приложенного напряжения. Из значений напряжений, при которых ток имеет минимумы, можно определить энергии возбуждения электронов в атоме
Дальнейшее развитие теории Бора
Несмотря на эти результаты и заявленную цель работы Бора 1913 г. — разработать общую теорию строения атома, эта теория давала строгое и адекватное объяснение только для атомов водорода и водородно-подобных атомов. Все попытки распространить ее на системы с более чем одним электроном были безуспешными. Даже спектр нейтрального гелия, который, как мы говорили, состоит из ядра, вокруг которого вращаются два электрона, не удавалось объяснить.
Одним из достижений теории Бора было объяснение серии линий, которые американский астроном В. Пикеринг (1858—1938) наблюдал в спектрах звезд. Предполагалось, что эти линии принадлежат водороду, поскольку их расположение очень напоминало серию Бальмера, но Бор показал, что на самом деле эти линии принадлежат ионизованному гелию, в котором одиночный электрон связан с ядром, имеющим заряд +2. Эйнштейн был на конференции в Вене в сентябре 1913 г., и когда ему сообщили об этом результате, воскликнул: «Тогда частота света вовсе не зависит от частоты электрона (т.е. от частоты его обращений вокруг ядра). Это огромное достижение. Теория Бора должна быть верной».
В своих исследованиях в 1913 г., немедленно после обсуждений теории атома водорода, Бор занялся атомами, содержащими несколько электронов. Он представлял эти атомы в виде системы, состоящей из положительно заряженного ядра, окруженного электронами, движущимися по круговым орбитам, и писал: «Мы будем предполагать, что электроны располагаются... в коаксиальных кольцах, вращающихся вокруг ядра». Проблема была в том, чтобы знать, сколько электронов могло находиться в каждом кольце, так, чтобы конфигурация оставалась стабильной, несмотря на расталкивающие электрические силы между электронами. Бор старался решить эту проблему с помощью классической динамики и начал с выяснения конфигураций простейших атомов. Для гелия, который имеет два электрона, он, справедливо, предположил, что они находятся на одной и той же орбите. Для лития (три электрона) он предположил, все еще справедливо, что два электрона располагаются на внутренней орбите (кольце), а третий располагается на большей орбите (новое кольцо). Для бериллия, который имеет четыре электрона, он предположил, что два электрона располагаются на одном кольце, а два на другом (эта гипотеза также впоследствии оказалась верной). Для атомов с большим числом электронов эти рассмотрения становились очень громоздкими. Наконец, он произвольно установил, что число электронов, располагающихся на внешних кольцах, должно быть равным числу, которым химики определяют валентность элемента.
Атом предполагался плоским, т.е. предполагалось, что ядро и все электроны лежат в одной плоскости. Гипотеза Бора была правдоподобна, но неэффективна, чтобы недвусмысленно определить распределение электронов по разным кольцам вокруг ядра. Эта неопределенность затрудняла подход к пониманию химических и физических свойств элементов, в стремлении получить периодичность, демонстрируемую таблицей Менделеева. Результат, к которому пришел Бор, состоял в том, что число электронов на внутренних кольцах должно увеличиваться с увеличением атомного номера. Это был ошибочный результат, который, однако, в 1913 г. не мог считаться таковым.
Читать дальше











