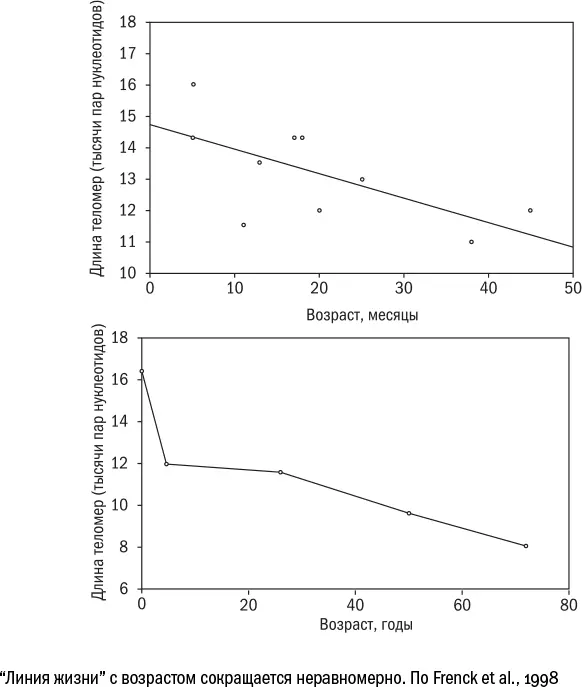
Но и динамические измерения порой дают совсем неожиданные результаты. Скорость укорочения теломер может меняться [405] Frenck R. W., Blackburn E. H., Shannon K. M. The rate of telomere sequence loss in human leukocytes varies with age // PNAS. 1998 May; 95 (10): 5607–5610.
с возрастом, по крайней мере в лейкоцитах крови. У маленьких детей они теряют около 10 % длины в год, затем в возрасте четырех лет их длина стабилизируется, а затем снова начинает медленно сокращаться. А в некоторых [406] Dugdale H. L. & Richardson D. S. Heritability of telomere variation: it is all about the environment! // Philosophical Transactions of the Royal Society B. 2018 Mar; 373 (1741): 2016.0450.
случаях длина теломер может даже возрастать, в том числе [407] Bateson M. & Nettle D. The telomere lengthening conundrum – it could be biology // Aging Cell. 2016 Dec; 16 (2): 312–319.
и у людей, например у пожилых [408] Blackburn E. H., Espel E. S., Lin J. Human telomere biology: A contributory and interactive factor in aging, disease risks, and protection // Science. 2015 Dec; 350 (6265): 1193–1198.
после 75 лет.
В 2019 году NASA опубликовало [409] Garrett-Bakelman F. E. et al. The NASA Twins Study: A multidimensional analysis of a year-long human spaceflight // Science. 2019 Apr; 364 (6436): eaau8650.
итоги своего близнецового эксперимента. Два брата-близнеца – один на орбите, другой на Земле – в течение почти целого года находились под пристальным вниманием врачей и ученых. Все это время у них собирали образцы биоматериала, чтобы оценить, как долгое пребывание в космосе влияет на физиологию человека. Помимо прочих параметров, у близнецов измеряли длину теломер в лейкоцитах. У "земного" близнеца за прошедший год теломеры, как и следовало ожидать, стали короче. А вот у его космического брата они изменялись не так линейно. К моменту возвращения на Землю они, наоборот, удлинились почти на 15 %, а после приземления в течение двух дней снова укоротились и стали в итоге меньше, чем были до отправления в космос.
Некоторые исследователи считают такие результаты артефактом эксперимента. Дело в том, что погрешность измерения теломер колеблется от 1,5 до 9,5 %, в зависимости от лаборатории и метода. При средней длине теломер в 7000 нуклеотидов в год человек теряет примерно 20–45 нуклеотидов. Таким образом, погрешность может составлять до 685 нуклеотидов, поэтому иногда может казаться, что теломеры растут из года в год.
Кроме того, за время эксперимента может измениться и состав ткани. Любые методы измеряют лишь среднюю длину теломер в клетках (как правило, лейкоцитов). Это значит, что и стволовые, и сенесцентные клетки вносят какой-то вклад в эту величину. И чем больше молодых клеток по отношению к старым находится в крови в данный момент, тем выше средняя длина теломер. Поэтому то, что кажется на первый взгляд омоложением отдельных клеток, может оказаться обновлением ткани в целом.
Значит ли это, что пребывание на земной орбите способно обратить старение вспять? Едва ли. Скорее, этот казус говорит о том, что линия жизни – не лучшая метафора для теломер. Ведь если их длина может меняться как в плюс, так и в минус, то едва ли по ней можно достоверно судить о возрасте.
В качестве альтернативы теломерам в последнее время все чаще используют часы метилирования, или эпигенетические часы, – набор меток на ДНК. На нити ДНК висят метильные группы, которые влияют на степень скручивания разных ее участков. С возрастом они перестраиваются: где-то меток прибывает, а где-то они, наоборот, исчезают. Соответственно, некоторые участки ДНК становятся доступнее для считывания, а другие, напротив, "закрываются". С самими генами при этом может ничего не происходить, меняется лишь их "актуальность", способность клетки ими воспользоваться – поэтому эти процессы назвали эпигенетическими, лежащими как бы "поверх" генетики.
Эпигенетические изменения затрагивают [410] Horvath S. & Raj K. DNA methylation-based biomarkers and the epigenetic clock theory of ageing // Nature Reviews Genetics. 2018 Apr; 19: 371–384.
далеко не весь геном, а лишь малую его часть: ДНК человека до 35 лет отличается от ДНК его родителей метилированием примерно трех процентов всей последовательности. Но здесь важно, какая именно часть генома становится доступной или, наоборот, закрывается. Иногда достаточно закрыть несколько генов, отвечающих за "стволовое состояние" клетки, чтобы она начала дифференцироваться и перестала быть стволовой, или открыть несколько копий ретротранспозона, чтобы запустить генетическую катастрофу.
В 2013 году американец Стив Хорват построил [411] Horvath S. DNA methylation age of human tissues and cell types // Genome Biology. 2013 Dec; 14: 3156.
систему определения возраста по метилированию ДНК, которую до сих пор иногда называют "часами Хорвата". Он проанализировал множество данных о расположении метильных групп на ДНК у людей разного возраста и обнаружил 353 участка, на которых наличие или отсутствие метилирования наиболее информативно. Из них 193 приобретают со временем метильную группу, а 160 – теряют ее. Модель Хорвата учитывает состояние всех 353 участков, суммирует их с определенным коэффициентом и предсказывает возраст с точностью до четырех лет.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













