Множество сочетаний "тип белка + пораженная область нервной системы" рождает целую палитру нейродегенеративных деменций. Вместе это семейство становится серьезной угрозой для человечества: по оценкам ВОЗ [357] Background Paper 6.11 Alzheimer Disease and other Dementias. https://www.who.int/medicines/areas/priority_medicines/BP6_11Alzheimer.pdf.
, сегодня деменцией страдает около 36 миллинонов человек в мире, а к 2050 году станет больше 115 миллионов, поскольку средняя продолжительность жизни неуклонно растет. Однако 60–70 % [358] https://www.who.int/news-room/fact-sheets/detail/dementia.
всех случаев деменции завоевала себе именно болезнь Альцгеймера, потеснив на этом фронте своих братьев и сестер.
Чем именно так примечательна болезнь Альцгеймера, до сих пор не вполне ясно. Возможно, дело во множестве факторов риска, которые усиливают вероятность того, что человек ею заболеет. Сегодня мы знаем столько этих факторов, что достоверно спрогнозировать развитие болезни невозможно. Среди них и возраст, и пол, и некоторые мутации, а еще гипертония, ожирение, синдром Дауна, травмы головного мозга и социальная пассивность. Ниже мы попробуем найти общую нить, которая связала бы с болезнью Альцгеймера каждый из них.
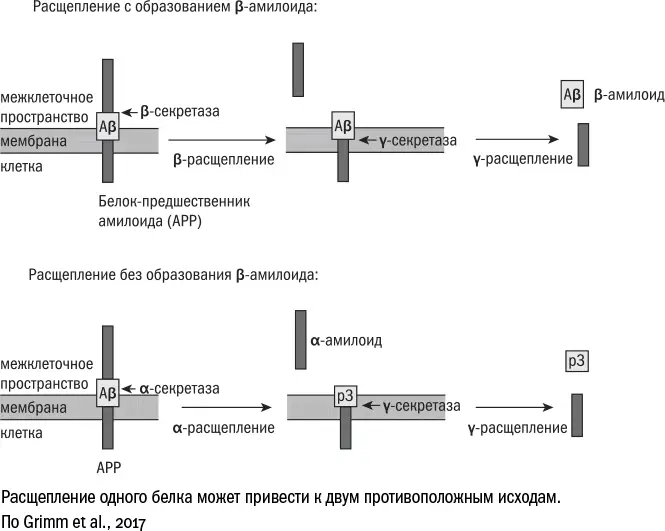
Каскад болезни Альцгеймера начинается с белка АРР (amyloid precursor protein). Он пронизывает мембраны многих клеток организма, например встречается даже в жировой ткани [359] An Y. A. & Scherer P. E. Targeting the amyloid precursor protein (APP) to mitochondria of white adipose tissues triggers mitochondrial dysfunction and obesity // Diabetes. 2018 Jul; 67 (Suppl 1).
, но больше всего его на нейронах. Точные функции АРР мы до сих пор представляем себе смутно. Судя по всему, основная роль этого белка – сигнальная. Время от времени ферменты α-секретаза (строго говоря, это не один фермент, а целая группа) и γ-секретаза (тоже большой молекулярный комплекс) отрезают [360] Grimm M. O. W., Mett J., Grimm H. S., Hartmann T. APP function and lipids: a bidirectional link // Frontiers in Molecular Neuroscience. 2017 Mar; 10: 63.
от АРР внеклеточную часть, которая уплывает в межклеточное пространство. Ее называют альфа-амилоидом, а служит она сообщением [361] Tyan S.-H. et al. Amyloid precursor protein (APP) regulates synaptic structure and function // Molecular and Cellular Neuroscience. 2012 Aug; 51 (1–2): 43–52.
для окружающих клеток: призывает стволовые клетки к дифференцировке и способствует образованию связей между нейронами. В общем, сам по себе белок АРР полезен и для клеток жизненно необходим. Даже коварные опухолевые клетки отказываются размножаться [362] Galvão F., Grokoski K. C., da Silva B. B., Lamers M. L., Siqueira I. R. The amyloid precursor protein (APP) processing as a biological link between Alzheimer's disease and cancer // Ageing Research Reviews. 2019 Jan; 49: 83–91.
, если отключить в них ген АРР.
Но иногда вместо α-секретазы за дело берется β-секретаза – похожий фермент, который разрушает молекулу АРР в другом месте. И когда γ-секретаза совершает последний надрез, от АРР отделяется бета-амилоид. Но, поскольку это не полноценный белок, а в некотором смысле "неправильный", он сворачивается не так, как внеклеточная часть АРР, и может вместо этого принимать самые разные формы. На поверхности бета-амилоида то и дело оказываются "липкие" части, которыми он соприкасается с другими молекулами и образует нерастворимые агрегаты – амилоиды, которые затем дорастают до крупных бляшек. В присутствии бета-амилоида нейроны постепенно гибнут, теряя связи друг с другом; смерть клеток провоцирует воспаление, а оно лишь усиливает нейродегенерацию.
Бета-амилоид может не только слипаться с другими частицами бета-амилоида, но и провоцировать [363] Nussbaum J. M., Seward M. E., Bloom G. S. Alzheimer disease. A tale of two prions // Prion. 2013 Jan; 7 (1): 14–19.
их "неправильное" сворачивание. Как только несколько молекул принимают характерную форму, они собираются в комок и стимулируют окружающие молекулы принять такую же форму и примкнуть к ним. Таким образом, бета-амилоид оказывается "заразен", а комки его распространяются по мозгу как снежный ком.
Заразным может оказаться и второй белок – примета болезни Альцгеймера: тау-белок [364] Clavaguera F., Hench J., Goedert M., Tolnay M. Invited review: Prion‐like transmission and spreading of tau pathology // Neuropathology and Applied Neurobiology. 2014 Nov; 41 (1): 47–58.
. Его основная функция – удерживать от распада клеточный скелет. Тау скрепляет "рельсы", по которым вещества путешествуют вдоль длинных отростков нейронов. Когда на клетку действует бета-амилоид или другие стрессовые факторы, на тау-белок навешивается фосфатная группа, чтобы разрушить и перестроить цитоскелет. Если таких фосфорилированных молекул тау становится много, они тоже слипаются и вызывают агрегацию соседей. Образуются нейрофибриллярные клубки – еще один снежный ком, только внутри клеток, а не снаружи.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













