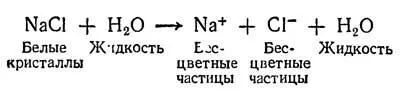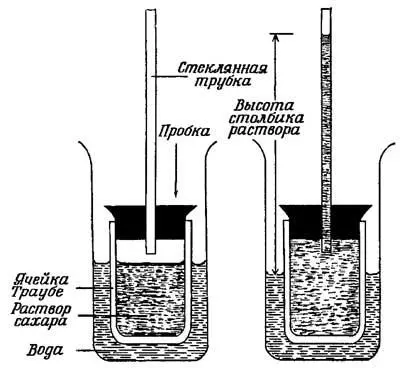
Рис. 11. Простой прибор, очень похожий на тот, которым пользовался Вильгельм Пфеффер, чтобы измерить осмотическое давление в растворе сахара.
Космические указатели времени Сванте Аррениуса
В конце лета 1884 года профессор химии Рижского политехнического училища (в будущем известный физико-химик) Вильгельм Оствальд взошел на корабль, направлявшийся в Стокгольм. У него была диссертация молодого шведа по имени Сванте Аррениус, которую он считал блестящей. По его мнению, труд Аррениуса недооценили в Упсальском университете. Хотя Аррениусу и присудили докторскую степень (под аккомпанемент традиционного пушечного салюта), его работу классифицировали как труд «четвертого класса».
Идеи, выдвинутые Аррениусом, могли оказаться правильными, и их признание, несомненно, открывало для химии новые перспективы. Поэтому Оствальд не успокоился, пока не предстал перед Пером Клеве — директором Упсальской лаборатории, столь небрежно отвергнувшим новую теорию Аррениуса. Теория электролитической диссоциации (так называлась эта теория) впоследствии была восторженно принята всеми химиками мира и принесла Сванте Аррениусу Нобелевскую премию по химии.
Сущность теории электролитической диссоциации сводилась к тому, что неорганические вещества при растворении распадаются на ионы, то есть атомы, или группы атомов, несущие определенные электрические заряды: одни — положительные, другие — отрицательные. И в тех случаях, когда химическая реакция протекает в растворе, она идет только между этими ионами.
Если, например, взять столовую ложку обычной поваренной соли и растворить ее в воде, произойдет следующее:
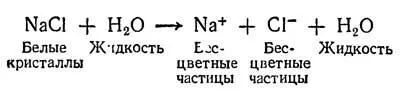
Химический элемент натрий — это легкий белый металл. Он очень мягок (его можно резать даже тупым ножом). Натрий настолько бурно реагирует с водой, что не может сохраняться на открытом воздухе, если в нем присутствуют хотя бы следы водяного пара. Хлор представляет собой желто-зеленый ядовитый газ. Когда атомы этих двух элементов электрически заряжены и находятся вместе в водном растворе, мы имеем всего лишь обычную соленую воду. При этом ионы натрия и хлора способны быстро реагировать с другими ионами, добавляемыми в воду.
Представитель старой школы, Клеве, смотрел на Аррениуса как на молодого выскочку, считая безответственным его назначение доцентом в Упсале и подозревая, что эта новая теория граничит с помешательством.

Рис. 12. Сванте Аррениус, лауреат Нобелевской премии 1903 года по химии.
Карьера ученого, отважившегося бросить вызов укоренившимся идеям, началась весьма бурно. И последующие годы его деятельности также не были спокойными. Аррениус продолжал бороться, поддерживаемый, кроме Оствальда, еще несколькими химиками, в том числе голландским профессором Якобусом Вант-Гоффом, и спустя много лет победил. В 1903 году Аррениус был удостоен Нобелевской премии по химии, а вскоре после этого Берлинская академия наук пригласила его на должность профессора химии. Еще позже Шведская академия наук предложила Аррениусу пост директора Института физической химии в Стокгольме. Здесь, в прекрасно оборудованной лаборатории, Аррениус мог без помех работать над проблемами физической химии, биохимии, иммунохимии, метеорологии и космической физики.
Одной из увлекавших его проблем был вопрос о том, каким образом влияние космических факторов отражается на физиологическом состоянии растений, животных и человека. За разработку этой проблемы Аррениус взялся с присущей ему смелостью.
Он изучил данные о периодических вспышках бронхита, о периодичности рождений и смертей в разных частях земного шара, о периодичности менструаций у женщин. По мнению Аррениуса, период во всех этих случаях примерно соответствовал лунному месяцу. Были у него и данные, на основании которых можно было предположить периодичность приступов эпилепсии. Аррениус сравнил графики, которые отражали наибольшие и наименьшие частоты этих физиологических изменений с графиками изменений концентрации электрических зарядов в атмосфере и заключил, что между этими явлениями существует совершенно определенная зависимость.
Читать дальше