Бензин. Экономим и делаем его сами 2012

Геннадий Николаевич Вакс
Руководство по изготовлению малогабаритного аппарата для домашнего изготовления 100 % заменителя бензина любой марки из воды и бытового газа, поступающих в квартиру, а также описание технологии его изготовления.
Краткие сведения о метаноле.
Метанол, метиловый спирт; древесный спирт, карбинол, СНзОН — простейший алифатический спирт, бесцветная жидкость со слабым запахом, напоминающим запах этилового спирта. Температура кипения — 64,5 градуса Цельсия, температура замерзания — минус 98 градусов, плотность — 792 кг/куб.м. Пределы взрывоопасных концентраций в воздухе 6,7—36 % объему. Октановое число больше 150. Теплота сгорания 24000 кдж/кг — меньше, чем у бензина (44000 кдж/кг), этому расход метанола будет выше примерно в два раза. Как топливо применяется в гоночных машинах, например в "Формуле-1".
Метиловый спирт смешивается в любых концентрациях с водой, органическими растворителями и является ядом. 30 миллилитров выпитого метанола смертельны! Пары также ядовит ы 1
Традиционно метанол получают возгонкой древесины. Но более перспективен способ получения метанола — из природного газа. Природный газ, как известно, чти на 100 % состоит из метана — C1L. Ни в коем случае не надо его путать с баллонным газом пропав-бутаном, последний является продуктом крекинга нефти и используется напрямую в качестве автомобильного топлива. Впрочем, это и делают многие автомобилисты, устанавливая соответствующее оборудование. А при использовании метанола никакого дополнительного оборудования не требуется. Мы дробно опишем, как, используя метанол в качестве топлива, как можно существенно повысить мощность двигателя.
Пока же только скажем, что это достигается увеличением диаметра главного жиклера и степени сжатия (повторяем, метанол имеет очень большое октановое число).
Итак, о химии процесса лучения метанола из природного газа.
Метан при неполном окислении превращается в окись углерода и водорода, реакция эта выглядит следующим образом:
2СН 4+О 2—>2СО+4Н 2+ 16,1 ккал.
Более простой технологически способ проходит реакции конверсии метана с водяным паром: СН 4+Н 20—>СО+ЗН 2— 49 ккал. В первом уравнении стоит "+16,1 ккал". Это означает, что реакция идет с выделением тепла. Во втором — с поглощением. Тем не менее, мы остановимся на втором с способе получения окиси углерода и водорода. При наличии этих двух компонентов уже можно напрямую синтезировать метанол. Реакция идет следующей формуле: СО+2Н 2<=>СН 3ОН.
Сложность в том, что конечный продукт получается лишь при высоком давлении и высокой температуре (Р>20 атм., Т=350 градусов), но при наличии катализатора этот процесс смещается вправо и при низком давлении, лученный метанол выводится из реакции охлаждением до конденсации, а не сконденсировавшие газы будем сжигать. При правильном сжигании остатков водорода и СО никаких вредных веществ не выделяется (отходы СО 2и Н 20 — безвредны), так что никаких вытяжных устройств не требуется. Дальше метанол заливается через трубку, обязательно с герметизацией (!), в канистру. Как видите, химический процесс очень прост, он основывается на двух реакциях. Сложности есть только технологические и мерам безопасности. Мы ведь имеем здесь дело с сильно горючими и ядовитыми веществами. Нужно опасаться как взрыва, так и утечки этих газов, этому — необходимо строжайше соблюдать технологию и правила обращения, которые мы будем описывать. Для сборки установки нужно будет приобрести: лист нержавеющей стали (1мм), трубку из "нержавейки" бесшовную, наружным диаметром 6–8 мм, толщиной стенок не менее 1 мм и длиной около 2 метров, компрессор от любого бытового холодильника (можно со свалок, но рабочий). Ну и само собой разумеется нужна будет аргоновая электросварка.
ТЕПЛООБМЕННИКИ.
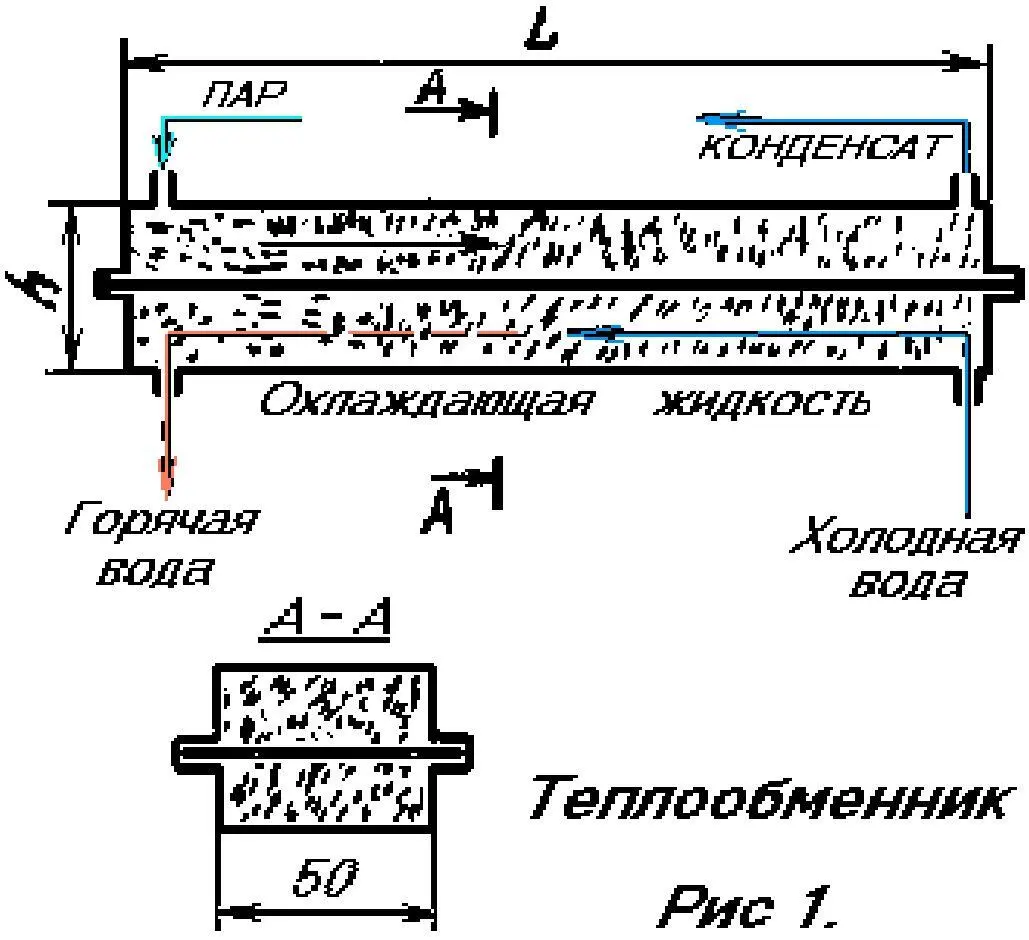
Теплообменники обычно состоят из трубок, окруженных охлаждающей средой. В обиходе их называют "змеевиками". Для жидкостей, теплопроводность которых велика, такой теплообменник может быть приемлем. Но с газами ситуация совершенно другая. Дело в том, что на небольших скоростях ток газа движется ламинарно и практически не обменивается теплом с окружающей средой, смотрите на дымок, подымающийся от горящей сигареты.
Читать дальше









![Геннадий Иевлев - Квантовая запутанность [litres самиздат]](/books/436969/gennadij-ievlev-kvantovaya-zaputannost-litres-sam-thumb.webp)




