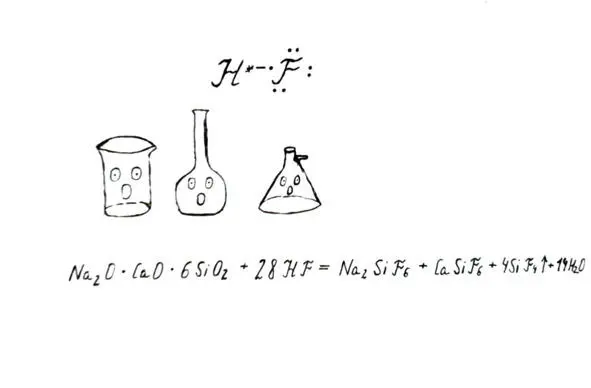
Стеклянная химическая посуда «боится» присутствия поблизости плавиковой кислоты
Плавиковая кислота в промышленности:
– катализатор в органическом синтезе;
– реактив для растворения силикатов;
– реактив для получения фторидов и фторорганических соединений.
Плавиковая кислота очень ядовита, обладает раздражающим действием, вызывает ожоги. Кроме того, фториды способны связывать кальций в крови, это ведет к нарушению сердечной деятельности, серьезным сбоям в организме человека. Опасность состоит еще и в том, что пагубное действие плавиковой кислоты имеет отложенный эффект, человек поздно обращается за помощью, когда патологический процесс уже запустился. Поэтому так важно работать с кислотой в защитной одежде, респираторе, очках, перчатках и в помещении с хорошей вытяжкой. В случае внештатных ситуаций плавиковую кислоту осторожно дезактивируют, основываясь на свойствах кислот нейтрализовываться щелочами (гашеной известью или содой).
Хлор. «Кто тут главный? Я тут главный!»
Наш следующий герой – любимец учебников по химии и заданий ЕГЭ, «звезда» группы галогенов – хлор.
Элемент хлор располагается в 3 периоде VIIA группе периодической системы Д. И. Менделеева. Атом хлора имеет в своем составе 17 протонов и, соответственно, 17 электронов, а вот число нейтроновварьируется. В природе наиболее широко распространены изотопы с массовыми числами 35 и 37 (массовое число = количество протонов + количество нейтронов). Исходя из процентного соотношения изотопов, относительную атомную массу хлора высчитали как равную 35,5. Этот момент необходимо помнить при решении задач.
На внешнем энергетическом уровне у атома хлора – 7 электронов. Принимая еще один электрон, атом приобретает степень окисления -1.Но у атома хлора, в отличие от «соседа сверху» – фтора, есть дополнительные орбитали, а именно – пять d-орбиталей. Хлор ведь в третьем периоде находится. Поэтому при определенных условиях электроны с р- и даже s-подуровней способны «перебегать» на d-орбитали и занимать там единолично «вакантные» места. Электроны – они ведь, как люди, в душе немного эгоисты. Каждому хочется иметь свою комнату, свое жизненное пространство. Одиночные электроны – возможность разнообразить степени окисления и образовать различные соединения с другими атомами.
Хлору проще принять один электрон, довести свой энергетический уровень до завершенности и получить степень окисления, равную -1 (самая распространенная в соединениях). Хлор – сильный окислитель.

Возможные степени окисления для хлора: -1 (принимает электрон), +1, +3, +5 и +7 (отдает свои электроны)
Молекулярный хлор состоит из двух атомов и представляет собой ядовитыйгаз желто-зеленого цвета с резким запахом, растворимый в воде. Значительно тяжелеевоздуха. Легко сжижается, ведь его температура кипения всего -34 градуса. Кстати слово «хлор» с греческого языка переводится как «зеленый».
Получение хлора
По традиции рассмотрим отдельно лабораторные и промышленные способы получения.
Впервые хлор удалось получить немецкому химику Карлу Шееле в 1774 году путем воздействия соляной кислоты на минерал пиролюзит (оксид марганца (IV)). Шееле заметил, что образовавшееся вещество обладает отбеливающими свойствами и имеет запах царской водки. Помимо способа Шееле в лаборатории хлор получают по реакции соляной кислоты с каким-нибудь сильным окислителем, например, с перманганатом или дихроматом калия. Соляная кислота выступает в роли восстановителя.
В заводских условиях хлор получают электролизом раствораповаренной соли. Хлор собирается на аноде, на катоде восстанавливается водород, а в растворе остается гидроксид натрия.
Полученный хлор хранят в стальных баллонах.

Применение хлора
Читать дальше








![Петр Дружинин - Загадка «Таблицы Менделеева» [История публикации открытия Д.И.Менделеевым Периодического закона]](/books/393460/petr-druzhinin-zagadka-tablicy-mendeleeva-istori-thumb.webp)





