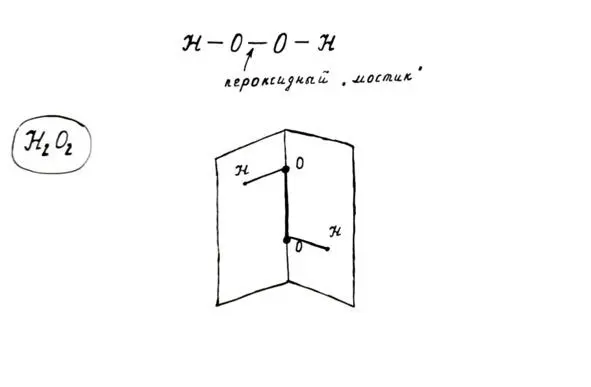
Строение молекулы пероксида водорода. Не будем забывать, что степень окисления кислорода в пероксидах равна -1
Химические свойства пероксида водорода

Распад пероксида водорода под действием катализатора
1. Как сильного окислителя. Окисляет многие восстановители: соли железа (II), йодиды, сульф иты, нитр иты.
2. Как восстановителя (с более сильными окислителями, например, с хлорной водой). Выделяется кислород.
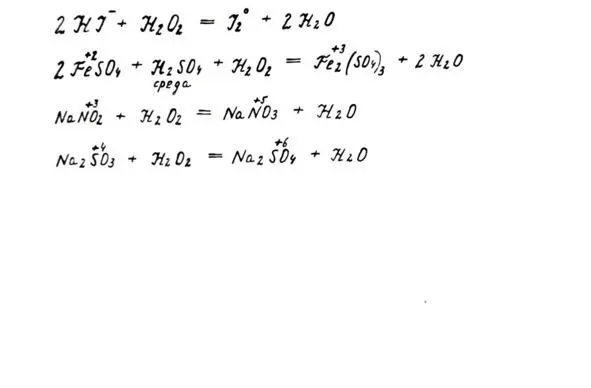
Свойства пероксида как окислителя
3. Как очень слабой кислоты (взаимодействие с некоторыми щелочами с образованием пероксидов тех металлов, которые входили в состав щелочи).
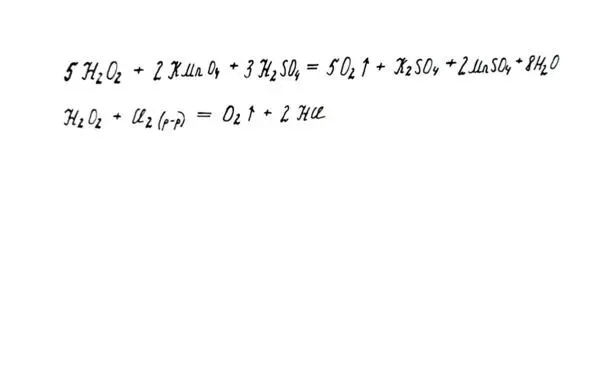
Свойства пероксида как восстановителя
Пероксид водорода находит широкое применение в медицине и промышленности. В виде трехпроцентного водного раствора известен как антисептическое средство. Все мы замечали, наверное: капнешь перекись на ранку, и ранка начинает «пузыриться», чуть ли не шипит. Это происходит распад перекиси и выделение кислорода, который рану дезинфицирует. А затевает реакцию фермент каталаза, содержащийся в крови.
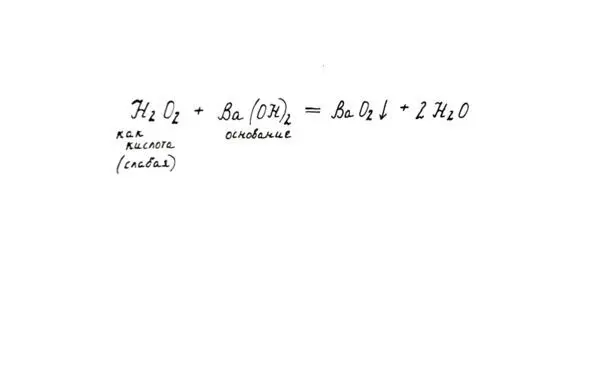
Свойства пероксида как кислоты
В промышленности используются концентрированные растворы пероксида водорода, называемые пергидролями. Они помогают отбеливать ткани, бумагу, осветлять старые слои красок на картинах, а в смеси с моющими средствами пригодны для уборки, дезинфекции. Только очень важнопри работе с пергидролем беречь кожу, чтобы не получить сильный ожог. Кроме того, пергидроль взрывоопасен.
Ой, еще про одно известное применение пероксида водорода не сказали. Многие женщины знают, что он входит в состав красок для волос в качестве осветляющего пигмент волос компонента.

Фтор. Господин окислитель
Следующим на повестке дня станет химический элемент, который по праву заслужил обращение «господин окислитель». Этот элемент, как многие, наверное, догадались, – фтор. Я заметила, что в большинстве учебников по химии фтору уделяется мало внимания, да и в заданиях ЕГЭ он находится в тени своих «собратьев» по группе – хлора, брома, йода. Попробую «реабилитировать» фтор, ведь каждый достоин внимания и заботы.
Месторасположение фтора в таблице Д. И. Менделеева – пересечение «2 период, VIIA группа» (как в морском бое). Фтор открывает собой группу галогенов – сильнейших окислителей.
В состав атома фтора входит ядро (в нем 9 протонов, 10 нейтронов) и 9 электронов, которые вращаются вокруг ядра, разместившись на двух уровнях.
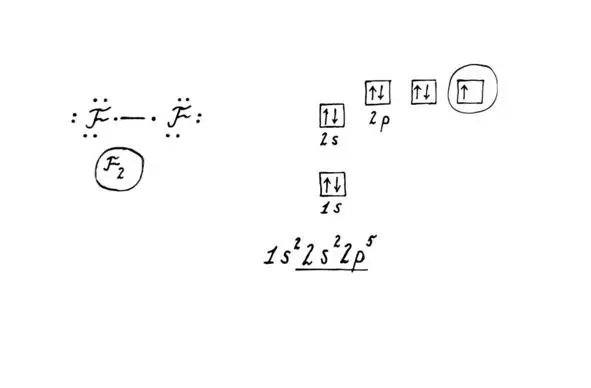
До завершения внешнего энергетического уровня (до 8 электронов) фтору не хватает всего 1 электрона. Ему проще «принять» электрон от другого элемента и так завершить свой уровень, чем «отдавать» кому-то 7 своих электронов и затрачивать на это колоссальную энергию. Прибавьте к этому малый радиус атома – и вот она, окислительная природа фтора, элемента с самой высокой электроотрицательностью. Электроотрицательность, условно говоря, – способность элемента «перетягивать» на себя чужие электроны. Поэтому степень окисления фтора в соединениях равна -1.
Молекула фтора состоит из двух атомов, соединенных друг с другом ковалентной неполярной связью. При обычных условиях фтор – это газ зеленовато-желтого цвета с резким запахом. Тяжелее воздуха. Ядовит! При температурах ниже минус 188 градусов переходит в жидкое состояние. В виде жидкости неограниченно растворяется в жидких кислороде, озоне.
Читать дальше



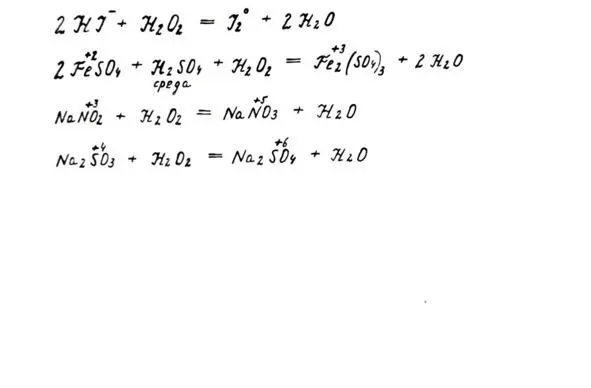
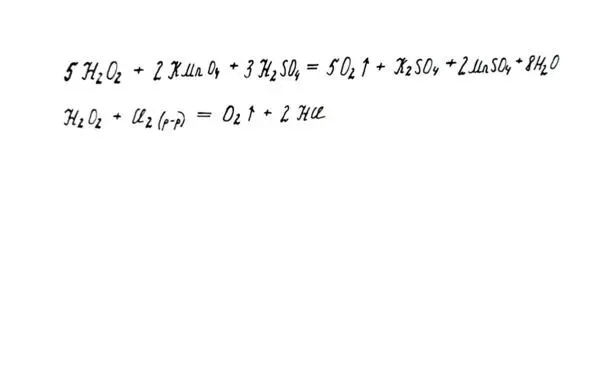
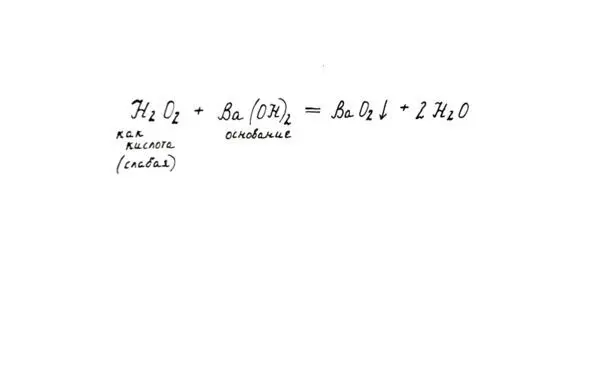







![Петр Дружинин - Загадка «Таблицы Менделеева» [История публикации открытия Д.И.Менделеевым Периодического закона]](/books/393460/petr-druzhinin-zagadka-tablicy-mendeleeva-istori-thumb.webp)





