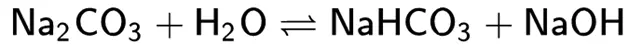На руках ощущается в виде мылкости
Щелочи – вещества, дающие в водном растворе ион гидроксила ОН¯
В моющих средствах применятся в основном гидроксид натрия (каустическая сода, каустик, NaOH), а также гидроксид калия (каустический поташ, КOH). Эти гидроксиды являются сильными основаниями и очень едкими. Из-за более высокой стоимости гидроксид калия применяется редко (например, в новом Ph Promline AL 01, остальные средства марки рН на гидроксиде натрия).
Щелочи активно реагируют с легкими металлами – алюминием, цинком, оловом. О реакции можно судить по выделению мелких пузырьков – водорода.
Цинк на объектах встречается в виде оцинкованного железа (после реакции защитный слой цинка растворяется, а железо начинает ржаветь) и сплавов типа латуни (после реакции желтая поверхность латуни краснеет – цинк из сплава вытравливается – т.е. растворяется).
Пищевым оловом часто покрываются латунные детали кофе-машин (после реакции поверхность желтеет – олово растворяется и на поверхность выступает желтая латунь, далее начнет краснеть по причинам, указанным выше).
Щелочные соли – вещества, дающие в ходе химической реакции с водой (реакция гидролиза) ион гидроксила ОН¯.
Пример реакции гидролиза:
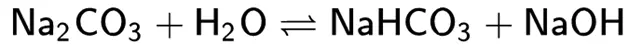
В моющих средствах играют роль создания щелочной среды – для более эффективного удаления ряда загрязнений. В отличие от щелочей не повреждают поверхности из цветных металлов (алюминий, оцинковка, латунь), а также многие (но не все!) чувствительные к щелочи поверхности.
ВАЖНО!При высоких концентрациях и высоких температурах начинают более активно гидролизоваться, соответственно выделяют больше гидроксида натрия и начинают вступать в реакцию с цветными металлами.
Применяются в основном следующие вещества (в порядке убывания активности):
– Метасиликат натрия (жидкое стекло, Na 2SiO 3) – самый распространенный щелочной компонент, применяется в средствах для удаления нагаров с алюминия (Ph Promline AL 04), средствах для мытья алюминиевой тары в посудомоечных машинах (Tana NOWA FLA), в мягких промышленных очистителях для цветных металлов и окрашенных поверхностей (Tana NOWA tanin).
– Карбонат натрия (кальцинированная сода, Na2CO3) – применяется в порошковых средствах для удаления нагаров с алюминиевых форм, в составе абразивных порошков типа Комет, иногда в средствах для мытья полов (не скользит, экология).
Щелочные ПАВы – дают в ходе химической реакции с водой (реакция гидролиза) ион гидроксила ОН¯. Являются очень слабыми основаниями и могут применяться на поверхностях, не стойких к воздействию щелочи (например, Ph средство для уборки на кухне – не содержит ни щелочей, ни щелочных солей, имеет рН 10,5).
Кислотные средства– средства, растворы которых имеют рН<6. Кислотную реакцию раствору дают определенные компоненты – кислоты, кислые соли, некоторые ПАВы.
Хорошо растворяют минеральные загрязнения (известь, ржавчину, высолы, остатки цемента и так далее)
Используются в санитарных зонах (в основном для мытья унитазов)
Используются для проведения уборок после строительства
Используются для очистки оборудования от извести (декальцинации)
На руках ощущается пощипывание возле поврежденных участков кожи
Кислоты – вещества, способные отдавать катион водорода Н +
По силе кислоты можно расположить в порядке возрастания силы:
уксусная → молочная → муравьиная → лимонная → щавелевая → ортофосфорная → сульфаминовая → азотная → соляная
При рассмотрении моющих средств можно разделить кислоты на группы по специфике взаимодействия с материалами:
Обычные кислоты– основное свойство кислот, применяемое в клининге – более сильные кислоты вытесняют более слабые кислоты из их соединений:
– известь – кальциевая соль очень слабой угольной кислоты, будет растворяться почти во всех кислотах.
– гипс – кальциевая соль очень сильной серной кислоты можно растворить только в более сильной кислоте (которые в нашей практике недоступны из-за высокой опасности)
Кислоты-окислители– способны на реакции окисления, в связи с чем выделяются на фоне других кислот.
Например, HNO 3– азотная кислота (входит в состав рН Средство для декальцинации плюс) при реакции с алюминием (без нагревания) выступает в качестве окислителя, а не кислоты, что приводит не к растворению алюминия, а наоборот – к утолщению защитной оксидной пленки. По такому же принципу азотная кислота воздействуют на нержавеющую сталь – утолщает оксидную пленку, и нержавейка становится более «нержавеющей».
Читать дальше