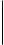K2S2O7 →K2SO4 + SO3
Cr2O3 +SO3→ Cr2 ( SO4) 3 (основное свойство)
В расплаве щелочи проявляются кислотные свойства оксида
Cr(III)
Cr2O3 + SO2 → CrO2 + H2O Cr2O3 обладает амфотерными свойствами
Cr(OH)3 – соединение переменного состава, (Cr2O3 ∙ nH2O) обладают амфотерными свойствами
При взаимодействии с кислотами образуются в водном растворе аквакомплекс синефиолетового цвета
[Cr(H2O)6]3+
При выпаривании водных растворов образуется устойчивый кристаллогидрат.
КCr(SO4)2 – хромокалиевые квасцы (используются в кожевен-но-обувной промышленности)
Cr(OH)3 + NaOH – Na3[Cr(OH)7]-3
на примере комплексных соединений Сr можно проследить явление изомерии
1) [Cr(OH ) 6]Cl3 CrCl3∙6H2O
сине-фиолетовый цвет
2) [Cr(H2O) 5Cl] Cr2∙H2O
сине-зеленый цвет
3) [Cr(H2O)4Cl2] Cl2∙H2O
темно-зеленый цвет
Данное явление получило название – ионизационная изомерия. В водных растворах соединения Cr(III) – легко гидролизуется.
[Cr(OH)6]3+
Cr(III) способен при взаимодействии с аммиаком образовывать комплексные соединения – аммиакаты, неустойчивость в водных растворах.
CrO3 представляет собой кристаллическое красное вещество, является очень сильным окислителем, взаимодействует с органическими веществами со взрывом.
При взаимодействии CrO3 + H2O → H2CrO4
Н2CrO4 известна только в растворах (нестабильна). Устойчивыми являются ее соли, которые называются хроматами. Цвет их в водном растворе – желтый. Окрашиваются ионы CrO4 – в желтый цвет. Хроматы получаются при действии сильных окислителей на соединениях Cr3+.
В зависимости от кислотности среды в водных растворах возможны равновесия между различными ионами
2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
водном растворе при рН>6 имеются только хромат-ионы в растворе желтого цвета. При подкислении происходит установление другого равновесия
2 CrO42– + 2H+ → 2HCrO4 → Cr2O7 + H2O

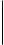
K 2 Cr 3 O 13
тетрахромат
K 2 Cr 3 O 10
трихромат
Cr2 O7 является производным неустойчивой двухромовой кислоты, Н2CrO7 для которых известны стабильные устойчивые соли, называются двухроматами. Наибольшее практическое значение имеют дихроматы щелочных металлов, которые используются в качестве сильных окислителей. Кристаллические Nа и К соли, носят название хромпески. Но в действительности в водных растворах возможно образование трихроматов, тетрахрома
тов, полихроматов.
K2Cr2O7
дихромат
Соединения хрома +6 являются сильными окислителями и используются с этой целью в химии и химической технологии. В процессе окисления образуются соединения хрома с устойчивыми степенями окисления +3.
Следует отметить, что наиболее сильными окислительными способностями обладают соединения Cr +6 в кислой среде.
Применение:
Сталь.
Химически устойчивые соединения (сплавы).
Получение феррохрома.
Молибден, Вольфрам, Мо, W.
ЛЕКЦИЯ 29.
Элементы VI-А группы
О, S, Se, Te, Po
Наличие соответствующих p-орбиталей
Для O характерным является степень окисления: -2, -1, +2. Для остальных элементов характерны следующие степени
окисления: -2, +4, +6, (+2)
Физические свойства
O, S, Se, Te, носят название халькогенов, что означает «образующие руды»
O
S
Se
Te
Po
r, нм
0,66
1,04
1,16
1,7
1.64
J, эв
13,61
10,36
9,75
9,01
8.43
р, г/см2
1,13
2,07
4,82
6,25
9,5
T ,С
–218,8
112,8
220,5
450
250
Относ.элек.
3,5
2.5
2,4
2.1
–
Таким образом, вниз постепенно уменьшается окислительная способность их, следовательно, возрастает их восстановительная способность.
Селен, Теллур, Полоний
Общее содержание
6 ∙ 10-5 6 ∙ 10-6
Se, Te относится к числу расс.элементов. В природе встречается как сопутствующий в сульфидных рудах Se, Te является полиизотопным элементом. Для Se известно 3 модификации, одна из которых является кристаллической. Для Те – 2 модификации. Эти модификации определяют пространственным строением атомов.
Se, Те не взаимодействуют с разбавленными НСl и H2SO4, од-нако взаимодействуют с НNO3
S + HNO3 →H2SO4 + NO2↑ + H2O
Se + HNO3 → H2SeO3 + NO2↑ + H2O
Н2ТеО3 – теллуристая кислота
В этих соединениях известны гидриды: Н2Э, которые получают или непосредственно взаимодействующих элементов или действием минеральными кислотами на соответствующие производные металлов.
Читать дальше
Конец ознакомительного отрывка
Купить книгу