Способы получения:
Ba(ClO3) 2 + H2SO4 → BaSO4↓ + 2HClO3
Ba(OH )2 + Cl2 → Ba(OCl2) + Ba(Cl3)2
Br02 + Cl02 +H2O → HBr+5O3 + HCl-1
J2 – HNO3 → HJOконц3. + NO↑ + H2O
Важное значение в практике приобрела хлорная кислота, которую получают двумя способами:
1) действие минеральных кислот на соответствующие соли хлорной кислоты (перхлораты)
2) путем электролиза хлоратов


а) Cl 2 +1 O
KСlO4 + H2SO4 → NСlO4 – KHSO4
конц.
HClO4 отгоняется с помощью водяного пара
[KCl+5O3 → KCL+7O4 + KCl-1]
Хлорная кислота является самой сильной из всех известных кислот. Насыщенные растворы являются сильнейшими окислителями. (Водные ее растворы – слабые окислители).
В присутствии HClO4 все остальные известные кислоты ведут себя как основания.
ЛЕКЦИЯ 24 Оксидогалогены
HCl <==> Cl2O↓ + H2O
Оксид Cl представляет собой темный газ, обладающий парамагнитными свойствами, являющийся сильным окислителем, а
также для получения гипохлоритов.
б) Cl+2O2
Темно-бурый газ, сильный окислитель, полученный при разложении хлорноватой кислоты (см. выше). При взаимодействии с водой:
ClO2 + H2O → HClO3 + HCl
ClO2 + KOH → KСlO3 + KСlO2
в) Cl2+4O4
Представляет собой светло-желтую жидкость, (открыта в
1970 г.), окислитель, неустойчивое соединение
г) Cl+6O3
Cl2O6 представляет собой красно-бурую жидкость, распадается по следующему уравнению:
Cl+62O6 + 2KOH → KCl+5O3 + KCl+7O4 + H2O
Обладает сильными окислительными свойствами.
д) Cl2+7O7
Маслянистая жидкость, полученная при действии фосфорного ангидрида на хлорную кислоту
6HClO4 + P2O5 → 3Cl2O7 + 2H3PO4
Представляет собой неустойчивое химическое соединение. Среди других, устойчивых оксидов галогенов известны J2O5 –
кристаллическое вещество, полученное в результате термического разложения
HJO3 → J2O5 – H2O
Применение галогенов (самостоятельно).
ЛЕКЦИЯ 25 Галогены
Расположение в периодической системе Д.И. Менделеева
Электронное строение.
Фтор 9F 1s22s22p5
Хлор 17Cl 1s22s22p63s23p5
Бром 35Br 1s22s22p63s23p5
Иод 53J 1s22s22p63p64s23d104p65s24d105p5
-I, +I, +3, -5, +7 -I, +I, +3, -5, +7 -I, +I, +3, -5, +7
Нахождение в природе и получение
Фтор: CaF2, Na3 (AlF6)
Хлор: NaCl, NaCl·KCl, KCl·MgCl2·6H2O
Бром: AgBr, в морской воде Иод: Ca(JO3) 2, в морской воде
F2: электролиз расплавов
A(+) 2F– – 2e → F2
Cl2: электролиз растворов, расплавов
Br2: 2Br-+Cl2=Br2+2Cl-
J2: 2J-+Cl2=J2+2Cl-
Основные физические свойства

Температура кипения,
°С
Фтор: газ
– 187
Хлор: газ
– 34
Бром: жидкость
58
Иод: крист. 184,5
Химические свойства и важнейшие соединения
Молекулы Г2 – окислители
В ряду F Cl Br J окислительная способность Г2 убывает, а восстановительная способность ионов F– увеличивается.
Свойства водородных соединений галогенов в растворе
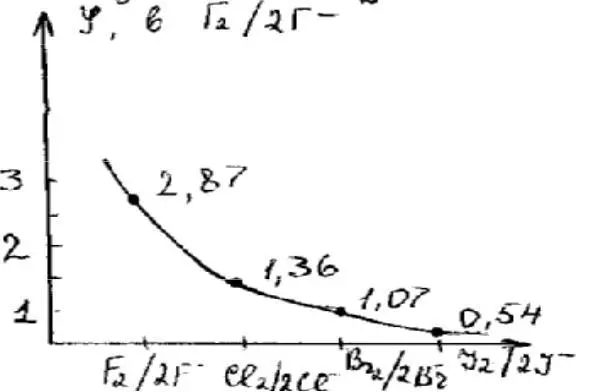
α в 0,1 м р-ре, %
HF
9,0
слабая к-та
HCl
92,6
HBr
93,5
сильные к-ты
HJ
95,0
Для HF:
…F-H…F-H…F-H…
ЕсвязиН…F=34 кдж/моль
ионы – Г – – восстановители Пример: убывание окислительной активности Г2
F2+H2=2HГ; G0 = – 270 кдж/моль
(в темноте, на холоде, со взрывом)
Cl2+H2=2HCl; G0 = – 95,2 кдж/моль
(с горением)
Br2+H2=2HBr; G0 =-53,5 кдж/моль
(при нагревании)
J2+H2=2HJ; G0 = +1,3 кдж/моль
(при сильном нагревании)
Пример: увеличение восстановительной активности ионов Г-
2KBr– + 2H+62SO4 = Br02 + SO+42 + K2SO4 + 2H2O 8KJ– + 5H2SO+64 =4J0 2 + H2S-2 + 4K2SO4 – 4H2O S+6 + 2e– → S+4
S+6 + 8e– → S-2
ЛЕКЦИЯ 26 Элементы VII – В
Общая характеристика
К этой группе относятся d-элементы (Мп, Т, Re)
Основные степени окисления Мп +2, +4, +6, +7 встречаются
(+3, +5, 0)
Для Тс и Re +7 Координационное число
Мп (4, 6), Тс, Re (2, 4, 6, 7, 9)
Мп
Тс
Re
4123d5
5124d5
6125d5
Ч, нм
0.130
0.136
0.137
J, эв
7.44
7.28
7.88
Содержание, %
310-2
–
8 10-9
Т пл., °С
1245
2200
3190
Для Мп известно в природе несколько минералов.
МпО2 (пиролюзит) Мп3О4 (гаусманит) Мп2О3 (браунит)
Re –рассеянный элемент, встречается в рудах, сопутствующий Мо
Получение Мп при электролизе МпSO4 или проводят восстановление Мп из его оксидов углеродом, алюминием или кремнием.
МпО2 + Si – Мп + SiO2
Обычно процесс восстановления Мп из его руд происходит совместно с оксидом Fe. В этом случае происходит образование смеси Fe с Мп, которое получает название ферромарганец (Ф).
Читать дальше
Конец ознакомительного отрывка
Купить книгу
















