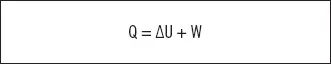3 Volumen (V): del fluido caloportador, ya sea líquido o gaseoso. El volumen se mide en metros cúbicos (m3) o en litros (l). Nota: un litro es la milésima parte de un metro cúbico.
4 Entalpía (H): cantidad de energía que un sistema puede intercambiar con su entorno. La entalpía se mide en Julios (J).
5 Temperatura (T): del fluido caloportador y de los focos. La temperatura se mide en grados Kelvin (K). Nota: un grado Kelvin equivale a 273 grados centígrados.
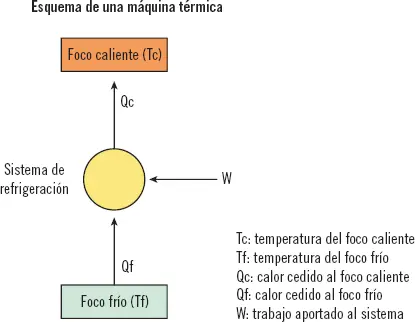
En todo ciclo termodinámico existirán al menos dos focos de temperatura, un foco frío, a menor temperatura, y un foco caliente, a mayor temperatura. En los ciclos de refrigeración, el calor se transmitirá siempre desde el foco frío hacia el foco caliente.
Siendo:
1 Tc: temperatura del foco caliente.
2 Tf: temperatura del foco frío.
3 Qc: calor cedido al foco caliente.
4 Qf: calor cedido al foco frío.
5 W: trabajo aportado al sistema.

Recuerde
En los sistemas de refrigeración el calor se transmitirá desde el foco frío hacia el foco caliente. De manera natural el calor fluye por sí solo desde el foco caliente hacia el foco frío.
2.1. Leyes de la termodinámica
Existen cuatro leyes de la termodinámica, las cuales se han de cumplir en todo ciclo termodinámico:
Ley cero de la termodinámica
La ley cero de la termodinámica, también llamada ley de equilibrio térmico,enuncia que dos cuerpos que se encuentran a la misma temperatura están en equilibrio térmico, no produciéndose intercambio de calor entre ellos.

Ejemplo
Si se vierte agua caliente en un vaso frío, el agua se enfriará, mientras que el vaso se calentará, hasta que ambos tengan la misma temperatura. En este momento se encontrarán en equilibrio térmico, no habiendo intercambio de calor entre ellos.
Primera ley de la termodinámica
También llamada principio de conservación de la energía,indica que la energía ni se crea ni se destruye, solo se transforma en otro tipo de energía. En este contexto hay que aclarar que tanto el calor como el trabajo son tipos de energía. De hecho, se define la cantidad de calor (Q) absorbida por un sistema como el cambio en su energía interna que no se debe al trabajo.
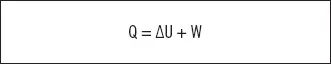
Siendo:
1 Q: calor absorbido.
2 ΔU: incremento de energía interna.
3 W: trabajo.

Ejemplo
Al calentar una olla exprés llena a la mitad de agua, al transmitir calor al interior de la olla, se generará vapor. El calor que se transmite a la olla se invierte en aumentar la energía interna del agua, que pasa de estado líquido a vapor, y en realizar un trabajo sobre las paredes de la olla y haciendo girar la válvula de seguridad.

Olla exprés, ejemplo de la primera ley de la termodinámica
Segunda ley de la termodinámica
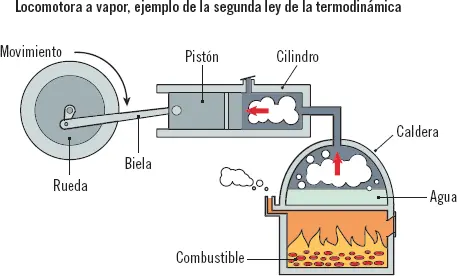
Esta ley especifica que solamente se puede realizar un trabajo mediante el paso del calor de un cuerpo con mayor temperatura a uno con menor temperatura. El calor fluye espontáneamente desde los focos calientes hacia los focos fríos, hasta alcanzar el equilibrio. Con esto se deduce que, para que el calor fluya desde los focos fríos hacia los focos calientes, habrá que aplicar trabajo al sistema.

Ejemplo
En una locomotora a vapor, una caldera genera vapor, el cual pasa de la caldera, a muy alta temperatura, al exterior, a temperatura ambiente, atravesando un pistón sobre el que genera un trabajo.
Tercera ley de la termodinámica
Por último, la tercera ley enuncia que no existe ningún proceso capaz de reducir la temperatura de un sistema al cero absoluto en un número finito de pasos. El cero absoluto equivale a cero grados Kelvin, es decir, a −273 °C.

Recuerde
En termodinámica es muy usual medir la temperatura en grados Kelvin (K). Para pasar de grados centígrados a grados Kelvin basta sumar 273.
0 °C = 273 K.
2.2. Procesos termodinámicos
Como ya se ha comentado, un ciclo termodinámico es una sucesión de procesos termodinámicos, partiendo de un estado inicial y volviendo a dicho estado inicial. Existen infinidad de procesos termodinámicos, según varíen las propiedades del sistema. Sin embargo, hay que diferenciar varios procesos termodinámicos característicos en los ciclos termodinámicos:
1 Proceso isotérmico: proceso en el que no varía la temperatura del fluido caloportador.
2 Proceso isócoro o isocórico: proceso en el que no varía el volumen del fluido caloportador.
3 Proceso isobárico: proceso en el que no varía la presión del fluido caloportador.
4 Proceso adiabático: proceso en el que no hay transferencia de calor entre el fluido caloportador y los focos.
5 Proceso isoentálpico: proceso en el que no varía la entalpía.
En termodinámica es muy común el uso de diagramas. Para representar los ciclos termodinámicos se usan principalmente dos tipos de diagramas: diagramas presión-volumen, P-V, y diagramas temperatura-entropía, T-S.
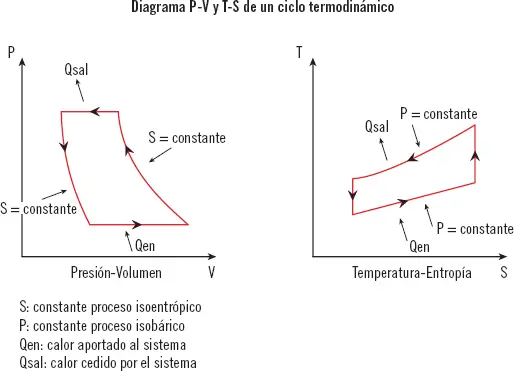
Siendo:
1 S: constante proceso isoentrópico.
2 P: constante proceso isobárico.
3 Qen: calor aportado al sistema.
4 Qsal: calor cedido por el sistema.
2.3. Ciclos de refrigeración
A continuación se analizarán brevemente los ciclos termodinámicos usados en refrigeración.
Ciclo de Carnot inverso
El ciclo de Carnot para refrigeración es el ciclo más básico. Para realizar este ciclo se utiliza un fluido compresible, el cual cambiará de estado. Las diferentes etapas de este ciclo se representan en la siguiente figura:
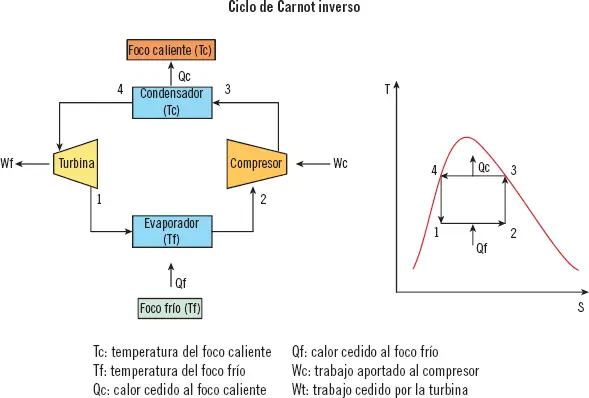
Siendo:
1 Tc: temperatura del foco caliente.
2 Tf: temperatura del foco frío.
3 Qc: calor cedido al foco caliente.
4 Qf: calor cedido al foco frío.
Читать дальше