1 ...7 8 9 11 12 13 ...17 В следящих приводах вязкостное трение играет роль демпфера, снижающего опасность возникновения автоколебаний.
Сжимаемость газа
Сжимаемость – свойство рабочего тела изменять свой объем под действием приложенного давления.
Коэффициент объемного сжатия β равен:
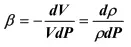 (21)
(21)
Несмотря на то, что молекулы жидкости подвижны, заметно сжать жидкость можно только приложив к ней очень большое давление.
Для практических целей можно считать жидкости несжимаемыми.
Термодинамические процессы при постоянном объеме газа
Сжимаемость газов гораздо выше и зависит от давления, температуры и объема, занимаемых ими. Бойлем в 1662 г. в Англии и независимо от него в 1676 г. Мариоттом во Франции было установлено, что если газ занимал некоторый начальный объем V ои имел давление Р о, то после сжатия его до объема V 1давление его, при условии, что температура газа не изменяется
(изотермический процесс) повысится до величины P 1, такой, что произведение начального объема и давления будет равно произведению конечного объема и давления:
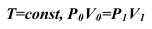 (22)
(22)
или
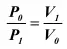 (23)
(23)
Важным следствием этого закона является то, что поскольку масса газа не меняется, при подстановке значений объемов из формулы (5), получим, что отношение давлений равно отношению плотностей газа:
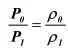 (24)
(24)
Изменение объема может происходить также и при изменении температуры Т тела, что учитывается коэффициентом объемного расширения
 (25)
(25)
Большинство твердых тел, жидкостей и все газы увеличиваются в объеме при нагревании. Опыты Гей-Люссака в 1802 году показали, что коэффициент объемного расширения всех газов одинаков
(рис. 8), постоянен и равен
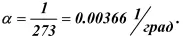
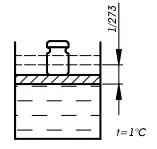
Рис. 8. Схема определения коэффициента объемного расширения по Гей-Люссаку.
Шарль установил, что если нагревать некоторую массу газа в закрытом сосуде, то на каждый градус увеличения температуры, давление Р в сосуде увеличивается на 1/273 часть давления Р опри 0 0С, то справедливо уравнение (рис. 9)
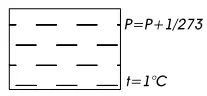
Рис. 9. Схема определения давления газа по Шарлю
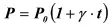 (26)
(26)
где:
Р о– давление газа при 0 0C
γ – термический коэффициент давления, равный
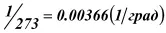
t – температура газа в градусах Цельсия.
Равенство коэффициентов α и γ не случайно, а обусловлено равенством отношений давлений и объемов по закону Бойля-Мариотта.
Шкала Цельсия не совсем удобна для измерения температуры газа, для того, чтобы обеспечить прямую пропорциональность давления и температуры. Из закона Шарля можно получить число T=273+t, которое можно рассматривать как температуру, отсчитываемую по новой, так называемой абсолютной шкале Кельвина, в которой цена градуса остается прежней, но за нуль принята точка, лежащая на 273 градуса ниже точки таяния льда.
Уравнение состояния идеального газа связывает все три важнейших параметра газа.
Смысл его состоит в следующем: Для данного количества идеального газа отношение
произведения давления на объем к абсолютной температуре есть величина постоянная. 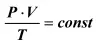 (27)
(27)
Читать дальше

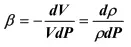 (21)
(21)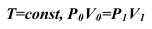 (22)
(22)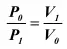 (23)
(23)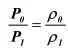 (24)
(24) (25)
(25)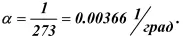


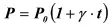 (26)
(26)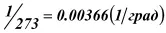
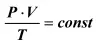 (27)
(27)









