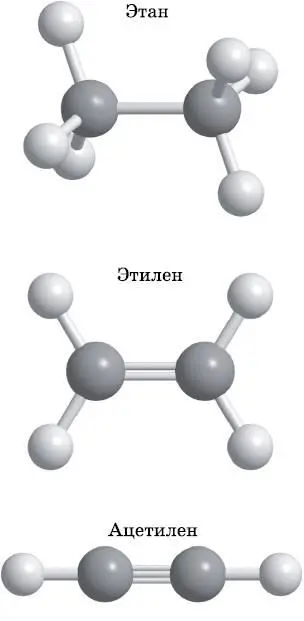
Рис. 14.14. Этан: одиночная связь, тетраэдрическая конфигурация связей углерода. Этилен: двойная связь, треугольная конфигурация связей углерода. Ацетилен: тройная связь, линейная конфигурация связей углерода
Таблица 14.1. Одиночные, двойные и тройные C−C-связи
Порядок связи, Длина связи, Энергия связи ( Дж )
Этан, Одиночная (1), 1,54Å, 5,8∙10 −19
Этилен, Двойная (2), 1,35Å, 8,7∙10 −19
Ацетилен, Тройная (3), 1,21Å, 16∙10 −19
Двойная углерод-углеродная связь — этилен
Для начала рассмотрим связь в молекуле этилена. Из рис. 14.15 видно, что углеродные центры здесь имеют треугольную форму. Как уже говорилось, для получения треугольной формы связей атом углерода будет использовать три sp 2-гибридизированные атомные орбитали для образования МО (см. рис. 14.7). Углерод имеет четыре валентные орбитали, служащие для образования химических связей: 2 s , 2 p x, 2 p yи 2 p z. В верхней части указанного рисунка молекула этилена располагается в плоскости xy . Таким образом, атомы углерода и водорода лежат в плоскости страницы, которая и есть xy . Чтобы образовать треугольную конфигурацию гибридных sp 2-орбиталей, служащих для формирования трёх связей, оба атома углерода используют 2 s -, 2 p x- и 2 p y-орбитали. С тремя гибридными sp 2-орбиталями каждый атом углерода будет создавать три σ-связи: одну — с другим атомом углерода и две — с атомами водорода. Эти σ-связи показаны в верхней части рис. 14.15.
Когда углерод образует три гибридные sp 2-орбитали из 2 s -, 2 p x- и 2 p y-орбиталей, у него остаётся 2 p z-орбиталь, которая не принимает участия в σ-связывании. В верхней части рис. 14.15 2 p z-орбиталь направлена поперёк страницы, выступая над ней и позади неё. Каждый атом углерода имеет один неспаренный электрон на 2 p z-орбитали. В нижней части рисунка молекула этилена изображена повёрнутой. Сигма-связь показана линией, соединяющей атомы. Положительные лепестки 2 p z-орбиталей перекрываются конструктивно, и то же самое происходит с отрицательными лепестками. Две 2 p z-орбитали объединяются и образуют π-связывающую молекулярную орбиталь (см. рис. 13.3). Это π-связь, поскольку у неё нет электронной плотности на линии, соединяющей центры атомов углерода. Совокупный результат состоит в том, что два атома углерода имеют двойную связь, состоящую из σ-связи, образованной sp 2-орбиталями каждого атома, и π-связью, образованной 2 p z-орбиталями тех же атомов.
Вращение вокруг двойной углерод-углеродной связи невозможно. Для него потребовалось бы, чтобы перекрытие двух 2 p z-орбиталей становилось всё хуже по мере увеличения угла поворота. При угле, равном 90°, две 2 p -орбитали были бы направлены перпендикулярно друг другу и не давали бы никакого перекрытия. Такой поворот разрушил бы π-связь, на что потребовалось бы значительное количество энергии.
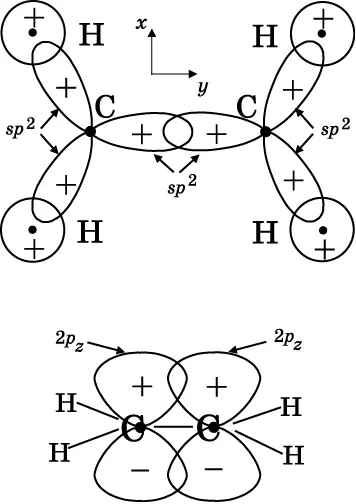
Рис. 14.15. Орбитали, образующие двойную связь в этилене. Вверху: каждый атом углерода использует три гибридные sp 2 -орбитали для образования трёх σ- связей в треугольной конфигурации. Страница соответствует плоскости xy, ось zнаправлена перпендикулярно этой плоскости. Внизу: каждый атом углерода имеет 2p z -орбитали, которые не используются в sp 2 -гибридизации. 2p z -орбитали объединяются и порождают π- связывающую молекулярную орбиталь, которая даёт вторую связь между атомами углерода
Как уже говорилось, измерения и теория позволили определить, что молекула бутана в жидкой фазе поворачивается вокруг одиночной C−C-связи примерно за 50 пс . Для этана это время составляет около 12 пс . Бутан вращается вокруг одиночной C−C-связи медленнее этана, поскольку содержит две дополнительные метильные группы (CH 3) — по одной с каждой стороны от двух центральных атомов углерода. Если поместить этилен в такую же жидкую среду при комнатной температуре, то, по грубым оценкам, потребуется около ста миллиардов лет для того, чтобы совершить поворот вокруг двойной связи, поскольку на разрушение π-связи требуется огромное количество энергии. Таким образом, в любом практическом смысле двойная связь (как и тройная) препятствует вращательной изомеризации между конформерами, которые различаются конфигурацией относительно двойной связи.
Читать дальше














