Три разные 2 p -орбитали схематически представлены на рис. 10.7. Как уже говорилось, 2 p -орбитали с учётом их формы обычно обозначают 2 p z, 2 p yи 2 p x. Каждая из этих орбиталей имеет два лепестка — положительный и отрицательный. Какой лепесток считать положительным, а какой — отрицательным, не важно, но знак должен меняться, поскольку имеется узловая плоскость. Лепестки 2 p z-орбитали расположены вдоль оси z . Узловая плоскость (на рисунке показана серым тоном) — это плоскость xy ( z =0). Вероятность обнаружить электрон на этой плоскости равна нулю. Знак волновой функции меняется при переходе через узел. У 2 s -орбитали имеется радиальный узел. Это сферическая поверхность на определённом расстоянии от центра, представляющая собой узел. Каждая из p -орбиталей имеет узловую плоскость, то есть совокупность направлений (плоскость), где располагается узел. У 2 p -орбиталей нет радиального узла, но у 3 p -орбиталей в дополнение к узловой плоскости есть радиальный узел, а у 4 p -орбиталей имеется два радиальных узла и т. д.
Лепестки 2 p y-орбитали направлены вдоль оси y , а её узловая плоскость — это xy . У 2 p x-орбитали лепестки направлены вдоль оси x , а узловой является плоскость yz . Приведённые на рис. 10.7 схематические изображения 2 p -орбиталей подобны изображениям s -орбиталей на рис. 10.2. Рисунок 10.7 позволяет понять, в каких областях амплитуда вероятности для электрона велика. Однако важно понимать, что эти волны амплитуды вероятности плавно спадают с удалением от ядра. На рисунке лепестки обрываются резко, но волновые функции на больших расстояниях ведут себя подобно тому, как это показано на рис. 10.3 для 1 s -орбитали. Тем не менее рис. 10.7 полезен для того, чтобы представить себе формы 2 p -орбиталей. Эти формы окажутся очень важными, когда речь пойдёт о молекулярных связях и формах молекул.
При n =3 число l может быть равно 0, что даёт 3 s -орбиталь. Также l может быть равно 1, что при m = 1, 0, −1 даёт три различные 3 p -орбитали. Кроме того, l может быть равно 2, что при m = 2, 1, 0, −1, −2 даёт пять различных 3 d -орбиталей. Они показаны на диаграмме энергетических уровней (см. рис 10.1). На рис. 10.8 изображено пять различных 3 d -орбиталей. Как и p -орбиталям, d -орбиталям часто дают названия, отражающие их форму, вместо того чтобы обозначать их квантовым числом m . Четыре из этих орбиталей имеют в целом одинаковую форму. У каждой имеется четыре лепестка и две узловые плоскости. Два из этих лепестков положительные, а другие два отрицательные. При пересечении узловой плоскости волновая функция меняет знак. Пятая орбиталь ( d x 2) имеет другую форму, но у неё по-прежнему две узловые поверхности. Это конические поверхности, изображённые на диаграмме. Как и в случае с p -орбиталями, на рис. 10.8 тоном выделены области с наибольшей амплитудой вероятности обнаружения электрона. Эти волны амплитуды вероятности спадают к нулю с увеличением расстояния от ядра.
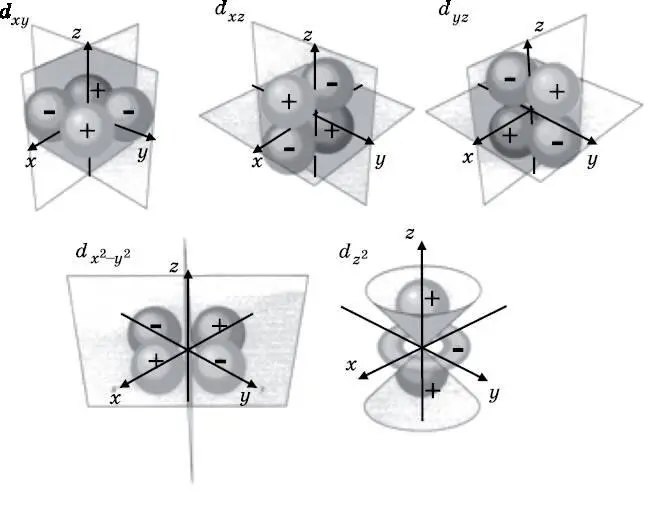
Рис. 10.8. Схематическое изображение пяти 3d-орбиталей атома водорода, обозначенных в соответствии с их формой. Каждая орбиталь имеет две узловые поверхности, а также положительные и отрицательные лепестки. На четырёх из них узловые поверхности имеют вид плоскостей, а на пятой — форму конусов. При пересечении узловых поверхностей волновая функция меняет знак. Лепестки на каждой диаграмме показывают, где расположены области наибольшей амплитуды вероятности для электрона. Четыре орбитали содержат по четыре лепестка каждая. Однако d x 2 — орбиталь имеет другую форму. У неё по-прежнему две узловые поверхности, но они имеют коническую форму. Все эти волны амплитуды вероятности плавно спадают к нулю с удалением от ядра (протона), а не обрываются резко, как на этих диаграммах
При n =4 в дополнение к s, p, d -орбиталям число l может быть равно 3, что позволяет числу m принимать семь различных значений. Существует семь f -орбиталей. Эти f -орбитали имеют по три узловые поверхности и обладают очень сложными формами. Как объясняется в следующей главе, посвящённой атомам тяжелее водорода, лишь очень тяжёлые элементы обладают электронами на f -орбиталях, и эти электроны обычно не принимают участия в образовании химических связей. Многие молекулы, в особенности те, в которых основным элементом является углерод, так называемые органические молекулы, зависят в основном от 2 s - и 2 p -орбиталей. Однако молекулы, содержащие тяжёлые элементы, например металлы, могут зависеть также и от d -орбиталей.
Читать дальше













