Существует более ста разных видов атомов, называемых «химическими элементами». Количество протонов в ядре каждого атома определяет, к какому элементу тот принадлежит: любой атом с 1 протоном будет водородом, с 8 протонами – кислородом, с 33 – мышьяком. Поскольку кислород нужен вам для выживания, а мышьяк является смертельным ядом, вы наверняка захотите узнать, сколько протонов содержат атомы разных элементов.
И тут вам повезло, поскольку мы изложили всю информацию по этому поводу в большой таблице, именующейся периодической таблицей элементов (приложение В). Таблица полная, соответствует научным представлениям на 2041 н. э., когда в ней произошли последние изменения. Атомы не могут терять или добавлять протоны, не превращаясь при этом в другие элементы, зато они могут добавлять или терять нейтроны и оставаться тем же, чем и раньше, такие варианты называются изотопами.
Изотоп с большим количеством нейтронов будет весить больше, чем изотоп с меньшим.
Вокруг ядра вращаются отрицательно заряженные электроны, они двигаются по разным орбитам, одни находятся ближе, другие дальше. На самой маленькой орбите может находиться два электрона, на второй – 8, на третьей 18 и так далее, где количество электронов определяется формулой 2(n 2), где n – номер орбиты, начиная от ядра.
И хотя электроны имеют тенденцию держаться ближе к ядру, внутренние орбиты не всегда должны быть заполнены электронами прежде, чем начнут «заселяться» внешние.
С учетом всего этого грубая модель атома может выглядеть следующим образом (рис. 49).
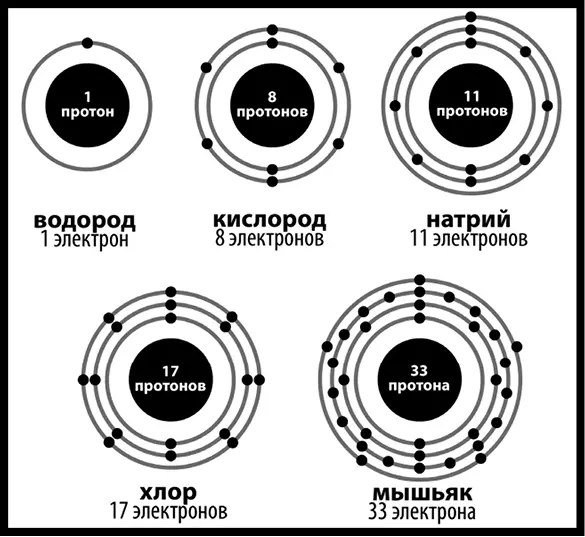
Рис. 49.Схематическое изображение нескольких элементов. Если вы ждали тут химическую шутку, то мы приносим наши извинения. Не в этот раз
Атомы могут комбинироваться с другими атомами, формируя таким образом молекулы: именно это и есть химические реакции, о которых вы слышали ранее. Электроны, расположенные вокруг атома, могут дать вам намек на то, насколько активен тот или иной из них: атомы желают, чтобы их внешние орбиты были заполнены электронами, так что элементы, добившиеся такого состояния, будут куда менее охотно вступать в реакции, чем их собратья, имеющие свободные ячейки.
И в общем все происходит так, как можно этого ждать: элементы с двумя дополнительными электронами имеют тенденцию вступать в реакцию с элементами, которым нужны два электрона для заполнения внешней орбиты. Это означает, что атомы, чья внешняя орбита (или оболочка) заполнена, – такие, как гелий или неон, – не будут вообще вступать в реакции.
Гелий и неон столь пассивны, что долгое время считалось – их невозможно встретить в составе молекул. На самом деле подобные молекулы существуют, изготовить их не такое уж большое дело, но они обычно возникают при предельно высоком давлении и (или) предельно низкой температуре.
Давайте посмотрим на воду как на пример химической реакции: два атома водорода и один атом кислорода могут образовать комбинацию, чтобы получилась вода, или Н 2О (2 говорит, что у нас тут два атома водорода). У кислорода на внешней электронной оболочке имеется шесть заполненных слотов, а у атомов водорода по одному электрону, так что два атома водорода делятся электронами с одним атомом кислорода, формируя молекулу воды, и если можно сказать об атомах, что они «счастливы» [205], то тут они находятся именно в таком состоянии.
Подобный дележ электронов называется ковалентной ат омной связью.
Но есть другой аспект, который необходимо рассмотреть: электрический заряд. Электроны несут отрицательный заряд, протоны – положительный, и поскольку у большинства элементов число нейтронов и протонов совпадает, то эти заряды обнуляют друг друга и атомы оказываются электрически нейтральными.
Тем не менее атомы не всегда делятся электронами, как это происходит в случае с водой. Иногда они могут обмениваться ими, и когда это происходит, то есть один из атомов теряет электроны, а другой их приобретает, в результате мы получаем два атома с разным по знаку зарядом. А противоположности (не только в химии, но и в романтических отношениях) притягиваются, в то время как подобия отталкивают друг друга.
Пример этого: натрий (Na в периодической таблице) может похвастаться 11 электронами: 2 на первом уровне, 8 на втором и 1 на внешнем. Хлор (Cl) имеет 17 электронов, что значит 2 на первом, 8 на втором и 7 на внешнем. Хлору требуется 1 электрон, чтобы заполнить внешний уровень, а если натрий избавится от одного, то его внешний уровень тоже станет полным, так что обмен происходит.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













