2.2. Учебный тезаурус химической дисциплины
Для приведения адаптационных возможностей студентов в соответствие с их адаптационными потребностями, возникающими при попадании в новую образовательную среду в ходе изучения общепрофессиональных и специальных дисциплин на соответствующих химических кафедрах, следует использовать возможности тезаурусного подхода, а именно выявить область «перекрывания» тезаурусов поэтапно изучаемых химических дисциплин. Для этого нами осуществлены предварительные операции, заключающиеся в выделении структурных компонентов теоретического ядра, базисного и функционального содержания дисциплины «Общая и неорганическая химия» и построении схемы ее обобщенной структуры. Выполнение данных операций проходило с опорой на научные разработки Ю.Н. Семина [64, с. 179]. Схема обобщенной структуры дисциплины, состоящей из компонентов теоретического ядра, базисного и функционального содержания, представлена на рис. 5.
К теоретическому ядру дисциплины «Общая и неорганическая химия» нами отнесены первичные понятия и категории, концептуальные модели-объекты; к базисному содержанию – научные теории, фундаментальные законы, принципы, базовые понятия, основные методы, понятия, производные от базовых, «именные» уравнения; к функциональному содержанию – теоремы, правила.
Структурными компонентами теоретического ядра дисциплины «Общая и неорганическая химия» являются:
• первичные понятия – ядро, заряд, масса, спин, атом, протон, нейтрон, электрон, энергия;
• концептуальные модели-объекты – ядерная модель атома, атомная орбиталь, молекулярная орбиталь, кристаллическая орбиталь, модель отталкивания валентных локализованных электронных пар, модель гибридизации валентных орбиталей центрального атома.
Базисное содержание дисциплины составляют:
• фундаментальные законы – периодический закон Д.И. Менделеева, закон Мозли, первый и второй законы термодинамики, закон Гесса, закон действующих масс, закон Фарадея;
• принципы – принцип неопределенности Гейзенберга, принцип наименьшей энергии, принцип запрета Паули, правило Хунда, принцип подвижного равновесия Ле Шателье;
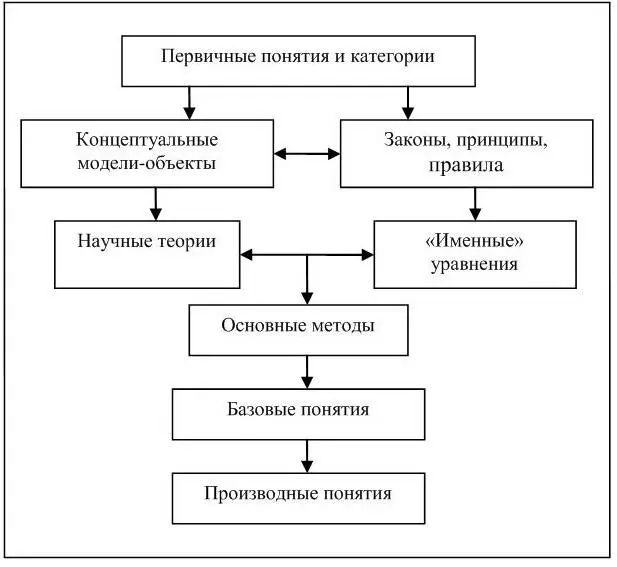
Рис. 5. Схема обобщенной структуры дисциплины «Общая и неорганическая химия»
• научные теории – теория молекулярных орбиталей, валентных связей, гибридизации, теория отталкивания локализованных электронных пар, кристаллического поля, зонная теория кристаллов, теория переходного состояния, теория электролитической диссоциации;
• основные методы изучения – метод молекулярных орбиталей, метод валентных связей, метод локализованных электронных пар;
• «именные» уравнения – уравнение Планка, уравнение де Бройля, уравнение Шредингера, уравнение Аррениуса, уравнение Нернста, уравнение Больцмана;
• базовые понятия – химический элемент, химическая связь, химическое равновесие, энтальпия, энтропия и т.д.
• понятия, производные от базовых, например полярная и неполярная связь, парамагнитная и диамагнитная молекула, экзотермический и эндотермический процесс и т.д.
Указанные компоненты обобщенной структуры дисциплины в то же время образуют иерархию ее дескрипторов, входящих в совокупности в учебный тезаурус. Выбор дескрипторов для учебного тезауруса «Общая и неорганическая химия» осуществлен экспертной группой на основании анализа образовательного стандарта, Программы общехимических дисциплин для подготовки специалистов инженерно-технологических специальностей, рабочей программы по этой дисциплине, учебной и учебно-методической литературы.
В учебном тезаурусе, оформленном в виде таблицы, отражена внутридисциплинарная логическая связь, установленная между дескрипторами, а именно указаны номера дескрипторов, используемых при изучении конкретного дескриптора. Кроме того, дескрипторы ранжированы в зависимости от их использования (усвоения) по трем уровням, и для каждого дескриптора указано необходимое для изучения время (в часах).
В качестве иллюстрации рассмотрим дескриптор «химическая связь» из класса базовых понятий. Данный дескриптор характеризуется первым уровнем усвоения, предполагающим общее представление студента о данном понятии, умение давать определение понятию, то есть семантизировать его, при необходимости производить символьный перевод, то есть из словесной формы в форму символов, моделей, графиков и др. (прил. 7). При его изучении используются дескрипторы «ядро», «электрон», «электронная плотность», «ковалентная связь», «ионная связь», «металлическая связь», «химическое соединение».
Читать дальше
Конец ознакомительного отрывка
Купить книгу













