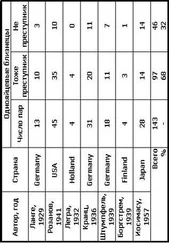
Решения уравнения Шрёдингера для многоэлектронных атомов показывают, что никаких принципиальных отличий в волновых функциях электронов, а следовательно, и в пространственном распределении плотности вероятности в таких атомах и в атоме водорода нет. Энергия электронов также имеет дискретные значения. Некоторые отличия, имеющиеся в волновых функциях и энергиях электронов, обусловлены электрон-электронными взаимодействиями.
34. МОЛЕКУЛЫ С ТОЧКИ ЗРЕНИЯ КВАНТОВОЙ ТЕОРИИ
При сближении атомы, начиная с некоторых расстояний, будут взаимодействовать между собой. Волновые функции наиболее удаленных от ядра электронов начинают перекрываться, что приводит к появлению сил притяжения или отталкивания. Под действием сил притяжения атомы будут объединяться в молекулы. Молекула – наименьшая частица вещества, обладающая его основными химическими свойствами и состоящая из атомов, соединенных между собой химическими связями.
В самом общем виде причина возникновения химической связи состоит в понижении электронной энергии образующейся молекулы по сравнению с суммой электронных энергий исходных атомов. Электронная энергия молекулы определяется взаимодействием каждого электрона с каждым электроном, каждого ядра с каждым ядром и каждого электрона с каждым ядром. Хотя все электронные взаимодействия в молекулах носят обычный электростатический характер, т. е. по своей природе являются кулоновскими, но вследствие волновых свойств электронов представляют собой взаимодействия не точечных зарядов, а электронных облаков. Это обстоятельство автоматически учитывается при решении уравнения Шрёдингера. Электронная энергия молекулы, так же как и электронная энергия атомов, имеет дискретные значения. Однако полная энергия молекулы, в отличие от полной энергии атома, включает в себя не только электронную энергию, но и энергии колебательного движения ядер и вращательного движения молекулы относительно ее центра масс, которые также являются квантованными. Это необходимо учитывать при анализе молекулярных спектров излучения и поглощения.
35. ОСНОВНЫЕ ТИПЫ ХИМИЧЕСКИХ И МЕЖМОЛЕКУЛЯРНЫХ СВЯЗЕЙ. ИОННАЯ СВЯЗЬ
Атомы в молекулах и кристаллах удерживаются почти полностью силами электростатического притяжения между отрицательно заряженными электронами и положительно заряженными ядрами. Роль сил магнитного происхождения весьма незначительна, а гравитационными силами вообще можно пренебречь. Взаимодействие атомов, возникающее в результате частичного или полного обобществления электронов и сопровождающееся уменьшением полной энергии молекул и кристаллов по сравнению с полной энергией их атомов в свободном состоянии, когда атомы удалены друг от друга на бесконечные расстояния, называется химической связью, а разность этих двух энергий – энергией химической связи.
Различают следующие основные типы химических связей:
1) ионная, или гетерополярная;
2) ковалентная, или гомеополярная;
3) металлическая.
К основным типам межмолекулярных связейотносят связь Ван дер Ваальса и водородную связь. Кратко рассмотрим каждый из названных типов связей.
Ионная связь обусловлена электростатическим взаимодействием противоположно заряженных ионов. К числу молекул с ионной связью можно отнести хлориды калия, натрия, окисел магния и прочее, а также кристаллы с аналогичным химическим составом. За счет электростатического притяжения ионы сближаются, их внешние электронные оболочки начинают перекрываться (рис. 1), что приводит к возникновению сил отталкивания.
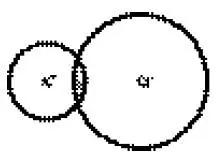
Рис. 1.Область перекрытия ионов K+ и Cl -, аппроксимированных сферами резко ограниченных радиусов в молекуле KCl
Отталкивание объясняется взаимодействием электронных оболочек ионов с учетом принципа Паули. Этот тип отталкивания является основным во всех молекулах, кроме самых легких (например, H 2). Отталкивание связано также с электростатическим взаимодействием ядер, но для всех молекул, за исключением самых легких, оно не является основным. На некотором расстоянии между ядрами силы притяжения уравновешиваются силами отталкивания, при этом энергия молекулы принимает минимальное значение, что соответствует устойчивому состоянию молекулы.
Читать дальше
Конец ознакомительного отрывка
Купить книгу