Репродукция вирулентного фага в клетках бульонной бактериальной культуры сопровождается их лизисом и просветлением среды. На газоне чувствительных бактерий, выращенных на агаровой среде в чашке Петри, фаги образуют зоны очагового или сплошного лизиса, что зависит от их концентрации. Зоны очагового лизиса получили название негативных колоний фага или стерильных пятен-бляшек. Они имеют морфологию, характерную для определенных фагов, и образуются из одной фаговой частицы при внедрении ее и последующей репродукции в клетках микроорганизмов.
Большинство фагов характеризуется видоспецифичностью в отношении бактерий. Однако существуют фаги, способные поражать только отдельные варианты одного и того же вида бактерий. Их используют для определения фаговаров (фаготипов) внутри данного вида.
В практической работе фаги применяют для:
– фаготипирования бактерий, что важно для маркировки исследуемых культур при эпидемиологическом анализе заболеваний;
– дифференцировки бактериальных культур с целью установления их видовой принадлежности;
– фагодиагностики, заключающейся в выделении фага из организма больного (например, из испражнений), что косвенно свидетельствует о наличии в материале соответствующих микроорганизмов.
Фаги, так как они обладают антигенными свойствами, используют также для иммунизации животных с целью получения диагностических антифаговых сывороток. Кроме того, в отдельных случаях их применяют для лечения инфекционных заболеваний (фаготерапии).
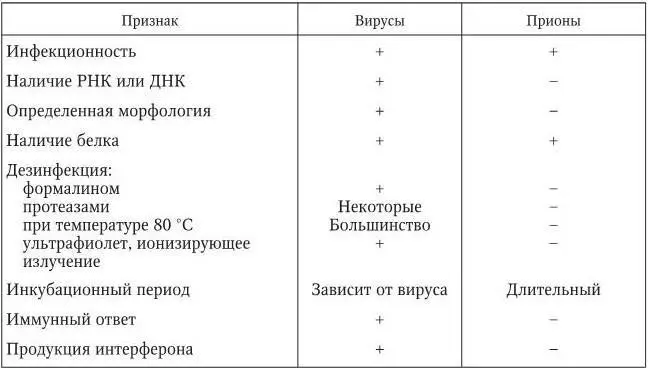
В 1957 г. американский врач Д. К. Гайдушек при обследовании в Новой Гвинее больных куру – смертельным дегенеративным заболеванием мозга, связанным с ритуальным каннибализмом, обратил внимание на сходство этого заболевания с давно известным медленным вирусным заболеванием овец – скрепи. Позже было выявлено сходство в развитии и некоторых других заболеваний, например болезни Крейтцфельдта – Якоба (БКЯ). За исследования в этой области Д. К. Гайдушек в 1976 г. был удостоен Нобелевской премии.
Инфекционный агент этих заболеваний имел важные отличия от других возбудителей, в том числе вирусов (табл. 1): он не был виден в электронный микроскоп, не вызывал иммунных реакций, не инактивировался факторами, разрушающими нуклеиновые кислоты, имел крайне малые размеры (меньше 25 нм). Ранее было высказано предположение, что этот агент представляет собой принципиально новый тип возбудителя – инфекционный белок.
Таблица 1
Сравнительная характеристика вирусов и прионов
В 1982 г. американский ученый С. Прузинер, используя новые подходы к накоплению и очистке возбудителя, выделил соответствующую протеиновую фракцию. Он доказал, что этот белок способен вызывать спонгиформную энцефалопатию и назвал его прионом (сокращение от протеиновые инфекционные нуклеолы ). В 1984 г. С. Прузинер установил, что прионы лежат в основе как наследственных, так и инфекционных болезней, что вызвало полное недоумение многих специалистов. Значительно позже, в 1997 г., этому ученому была присуждена Нобелевская премия в области физиологии и медицины за серию научных работ о прионах.
Существуют так называемые «конформационные» болезни, которые характеризуются пространственным изменением третичной структуры внутриклеточных белков с образованием жесткой бетаструктуры вместо нормальной альфа-спиральной. Бета-структуры, в отличие от альфа-структур, становятся устойчивыми к расщепляющим их ферментам, вследствие чего накапливаются, агрегируются и полимеризуются, формируя различные специфические и неспецифические внутриклеточные включения (фибриллы, агрегаты и амилоид). Некоторые из них приобретают новые, в частности нейротоксичные, свойства, становясь причиной развития целого ряда нейродегенеративных заболеваний (болезни Альцгеймера, бокового амиотрофического склероза и др. ).
Конформационные изменения белков в организме в определенных условиях происходят и в норме, однако в условиях патологии процесс изменения структуры белка резко ускоряется, что может быть обусловлено как эндогенными (мутации, ошибки транскрипции и трансляции), так и экзогенными факторами (окислительный процесс, вирусы и их генные продукты). Таким образом, среди конформационных болезней можно выделить инфекционные, наследственные и спорадические формы. Некоторые конформационные болезни могут проявляться во всех трех формах. К числу последних относятся крайне актуальные в настоящее время прионные инфекции. Прионы представляют собой сиалогликопротеид (PrP) с молекулярной массой 33 – 35 кД, состоящий из 254 аминокислот (включая 22-членный N-терминальный сигнальный пептид), к боковым цепям которых присоединены остатки сахаров. Прионный белок очень устойчив к различным физическим факторам и химическим веществам. Инактивации его можно добиться только обработкой 90 % фенолом и автоклавированием при самом жестком режиме (табл. 2).
Читать дальше













