а) с металлами
________________________________________________________________________
б) с оксидами металлов
________________________________________________________________________
в) с основаниями и амфотерными гидроксидами
________________________________________________________________________
г) с солями
________________________________________________________________________
д) с аммиаком
________________________________________________________________________
2. Восстановительные (особенно HI)
O 2:____________________________________________________________________
H 2SO 4 (конц.):_________________________________________________________
3. Особые
SiO 2+4HF:____________________________________________________________
KOH +2HF:___________________________________________________________
Соли. Галогениды
Хлориды НЕ являются восстановителями!
KCl + H 2SO 4 (конц.):_____________________________________________________
KBr + H 2SO 4 (конц.):____________________________________________________
KI + H 2SO 4 (конц.):______________________________________________________
Гидродиз галогенидов
PCl 3:_________________________________________________________________
SiBr 4:_________________________________________________________________
Кислородсодержащие кислоты (на примере хлора)
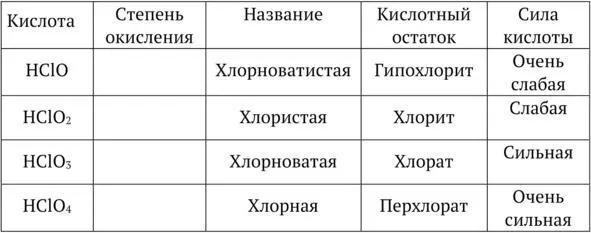
Хлорноватистая кислота HClO, гипохлориты
Получение
1. Из солей
________________________________________________________________________
2. Растворение хлора в воде
________________________________________________________________________
Химические свойства
1. Разложение на свету
________________________________________________________________________
2. Термическое разложение
________________________________________________________________________
3. Разложение под действием водоотнимающего средства (CaCl 2)
________________________________________________________________________
4. Окислитель
________________________________________________________________________
Хлористая кислота HClO 2, хлориты
Получение
1. Из солей
________________________________________________________________________
2. ClF 3+ H 2O:________________________________________________________
3. Взаимодействие перекиси водорода и оксида хлора (IV)
________________________________________________________________________
________________________________________________________________________
Химические свойства
1. Разложение
________________________________________________________________________
2. Кислотные свойства
________________________________________________________________________
3. Окислительно-восстановительные
________________________________________________________________________
________________________________________________________________________
Хлорноватая кислота HClO 3, хлораты
Получение
1. Из солей ___________________________________________________________
2. Разложение хлорноватистой кислоты
________________________________________________________________________
3. Хлорат калия (бертолетова соль)
________________________________________________________________________
Химические свойства
1. Окислитель (H +, tº)
________________________________________________________________________
2. Каталитическое разложение бертолетовой соли
________________________________________________________________________
3. Термическое разложение бертолетовой соли
________________________________________________________________________
4. Бертолетова соль с серой
________________________________________________________________________
5. Бертолетова соль с фосфором
________________________________________________________________________
Хлорная кислота HClO 4, перхлораты
Получение
1. Из солей
________________________________________________________________________
2. Электрохимическое окисление HCl
________________________________________________________________________
Химические свойства
1. Термическое разложение
________________________________________________________________________
2. Разложение под действием водоотнимающего средства (P 2O 5)
________________________________________________________________________
3. Кислотные свойства (самая сильная кислота)
________________________________________________________________________
4. Окислитель
________________________________________________________________________
ДЛЯ ЗАМЕТОК
Общая характеристика
1. Положение в ПС __________________________________________________
2. Строение атома (число e -, n 0, p +) ________________________________
3. Электронная конфигурация _____________________________________
4. Внешний электронный уровень _________________________________
5. Валентности ______________________________________________________
6. Степени окисления (в соединениях):
– 2
– 1
0
+2
Степень окисления 0. Простые вещества. Кислород
Физические св-ва
O 2_____________________________________________________________________
Получение
В помышленности
1. Электролиз воды
________________________________________________________________________
2. Из воздуха
3. Фотосинтез
________________________________________________________________________
В лаборатории
Разложение
1. перманганат калия
________________________________________________________________________
2. дихромат калия
________________________________________________________________________
Читать дальше













