Химические свойства
При комнатной температуре
1. С металлами I, II группы (кроме Mg, Be)
________________________________________________________________________
2. С основными оксидами (если образуется щелочь)
________________________________________________________________________
3. С галогенами
F 2:_____________________________________________________________________
Cl 2: ___________________________________________________________________
________________________________________________________________________
4. С кислотными оксидами (кроме SiO 2)
________________________________________________________________________
5. C ангидридами и галогенангидридами карбоновых
и неорганических кислот
________________________________________________________________________
________________________________________________________________________
6. С активными металлорганическими соединениями
(RMgBr, CH 3Na и т. д.)
________________________________________________________________________
7. С карбидами, нитридами, фосфидами, силицидами,
гидридами активных металлов (Ca, Na, Li и др.)
________________________________________________________________________
8. C галогенидами неметаллов (P, Si)
________________________________________________________________________
9. С солями (гидролиз)
________________________________________________________________________
При нагревании
10. С металлами (Mg, Mn – Pb)
Mg:___________________________________________________________________
Zn:____________________________________________________________________
Fe:____________________________________________________________________
11. С углем, метаном
С:_____________________________________________________________________
CH 4:___________________________________________________________________
В присутствии катализатора
12. С амидами, эфирами карбоновых кислот (H +)
________________________________________________________________________
13. С ацетиленом и другими алкинами (Hg 2+)
________________________________________________________________________
________________________________________________________________________
14. С алкенами (H +)
________________________________________________________________________
15. С нитрилами (H +)
________________________________________________________________________
ДЛЯ ЗАМЕТОК
Общая характеристика
1. Положение в ПС _____________________________________________________
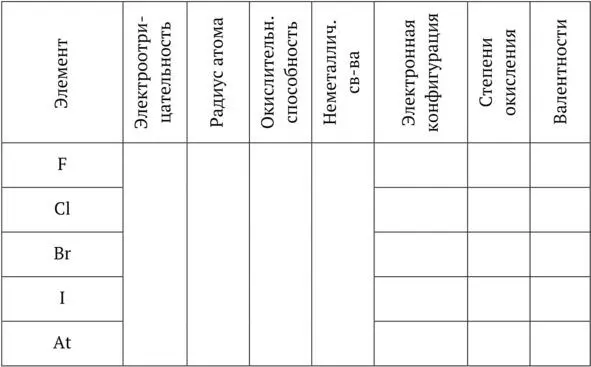
Степень окисления 0. Простые вещества
Получение
В промышленности
1. Электролиз расплавов и растворов солей (единственный
способ получения фтора)
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
2. Окисление солей хлором (для брома и йода)
________________________________________________________________________
В лаборатории (окислители PbO 2, KMnO 4, KClO 3, K 2Cr 2O 7)
3. Окисление галогеноводородов (для хлора, брома, йода)
________________________________________________________________________
4. Окисление солей (для йода)
________________________________________________________________________
Химические свойства
1. С металлами
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________
2. С неметаллами
(F 2 – со всеми, Cl 2 – кроме O 2, N 2, инертных газов)
________________________________________________________________________
________________________________________________________________________
Hal 2 + F 2= 2Hal +F -
3. С водой
F 2:_____________________________________________________________________
Cl 2:____________________________________________________________________
4. С щелочами
F 2:_____________________________________________________________________
Cl 2:__________________________________________________________ (tкомн.)
Cl 2:__________________________________________________________ (нагрев)
I 2:________________________________________________________ (tкомн., tº)
5. C другими соединениями
SO 2:____________________________________________________________________
K 2CO 3:________________________________________________________________
NH 3:__________________________________________________________________
NaNO 2+ H 2O:________________________________________________________
Особые свойства
Фтор
2NaOH +2F 2 = OF 2+2NaF + H 2O (разбавленная щелочь)
Хлор, бром
1. P:___________________________________________________________________
2. S:___________________________________________________________________
3. Si:__________________________________________________________________
Йод
1. Fe:__________________________________________________________! (FeI 3)
2. Восстановитель
Cl 2:____________________________________________________________________
3. Окислитель
Na 2S 2O 3:_______________________________________________________________
SO 2+2H 2O:___________________________________________________________
Степень окисления -1. Галогеноводороды
Получение
1. Гидросульфатный (HF, HCl)
________________________________________________________________________
2. Из галогенидов неметаллов (HBr, HI)
________________________________________________________________________
3. Из солей (HI)
________________________________________________________________________
4. В промышленности
________________________________________________________________________
Химические свойства
1. Кислотные
HF → HCl → HBr → HI → сила кислот увеличивается
HF – слабая, остальные сильные
Читать дальше













