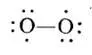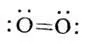__
Железо, являсь основным компонентом, окисляется до оксида FeO. Этот оксид затем вступает в химические реакуии окисления примесей, в результате которых железо вновь восстанавливается.
Fe + О 2→ 2FeО
2FeO + Si → SiO 2+ 2Fe
FeO + Mn → MnO + Fe
FeO + С → CO + Fe
Вместе с тем, окисление примесей может происходить кислородом напрямую:
С + О 2→ СО → СО 2
Si + О 2→ SiО 2
2Mn + О 2→ 2MnО
__
В химии углеводородов рассматриваются механизмы реакций на поверхности кристалла. Считается, что молекулы перед взаимодействием адсорбируются на поверхности металла и за счет связей с металлом, ослабляются связи в молекулах, после чего становится возможным реакция между двумя молекулами и десорбция продуктов с поверхности. Например, для таких процессов можно записать схему:
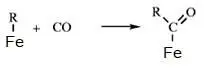
В механизмах реакций в кристаллах отличие состоит в том, что молекулы входят в состав кристаллической решетки и реакции происходят в слоях решетки.
Схему превращений кислорода можно записать в виде [35,с.39]:
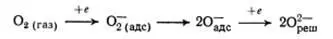
Молекулы О 2распадаются на два иона, которые перемещаются в вакансии решетки (в пустоты решетки) и образуют химическую связь с атомами железа. После химической адсорбции О 2на поверхности, происходит перенос электрона из решетки на молекулу О 2. После этого молекула О 2диссоциирует на ионы. Центр адсорбции перестраивается и кислород переходит в структуру решетки кристалла. Кислород может находиться кроме ионов в виде поверхностных окислов различного состава.
Перестройка поверхности решетки металла происходит под действием химической адсорбции или непосредственно из-за реакций окисления [35,с40].
Для кислорода можно предположить существование вид химической абсорбции:

Точные представления получаются квантово-механически расчетом для кластера. Затем происходит распад связи О-О и встраивание кислородного радикала в решетку.
Полинг в работе [35,с.179] указывает структуру кислорода в виде бирадикала с двумя неспаренными атомами:
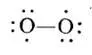
Структура с двойной связью является ошибочной [35,с.179]:
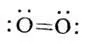
Молекула кислорода имеет электронную конфигурацию:
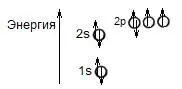
находится в триплетном состоянии, т.е. с одним неспаренным электроном на одной орбитали.
Условная схема sp 3-гибридизации атома уислорода О:
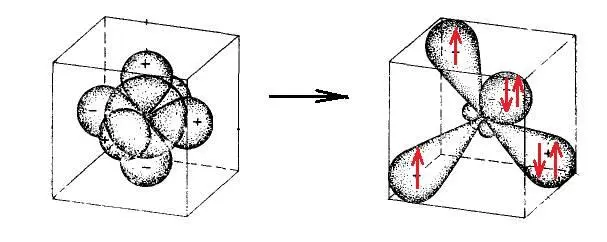
Упрощенная наглядная схема молекулы кислорода (стабильного бирадикала):
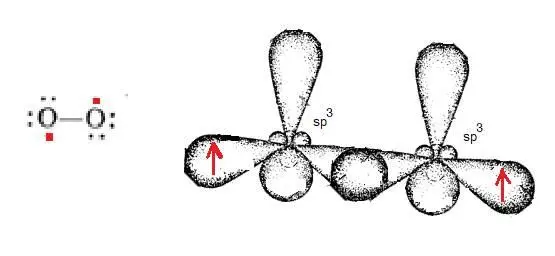
Наличие одного неспаренного электрона на орбитали соответствует радикалу (для молекулы – бирадикалу) и соответствует структуре Полинга. Здесь показаны орбитали молекулы с сохранением индивидуальных орбиталей для каждого атома.
Поэтому для рассматриваемой реакции окисления кристалла железа безразлично окисляет непосредственно молекула О 2или радикалы, полученные после распада молекулы. Точный ответ можно найти квантово-механическим расчетом в компбютерной программе.
Атомы после соединения в молекулу О 2имеют общие орбитали, которые выглядят по-другому и рассчитываются методом молекулярных орбиталей.
Распределение электронной плотности по данным Ахметова [12,с.64]:
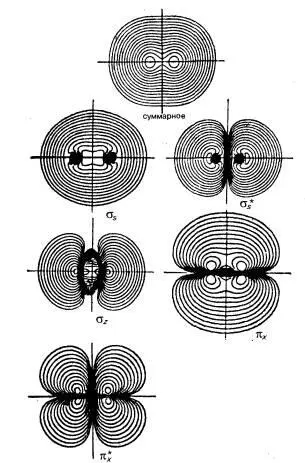
Поэтому молекула кислорода может непосредственно окислять атомы железа, или окислять могут кислородные радикалы. Точный механизм атаки кислорода может быть установлен только квантово-химическим расчетом в специальном программном пакете.
Рассмотрим механизм окисления решетки из атомов железа молекулой кислорода согласно схемы Fe + О 2→ 2FeО:
Читать дальше
Конец ознакомительного отрывка
Купить книгу