Следующим по ценности в этом списке идет графит, в котором атомы углерода расположены совершенно иначе; это мы и называем явлением полиморфизма . Полиморфные модификации – это такие вещества, которые имеют одинаковый химический состав, но разное пространственное расположение атомов. В особых случаях, когда простое вещество существует в разных формах, такие формы называют аллотропами или аллотропными модификациями . В графите, в отличие от трехмерной алмазной решетки, атомы углерода формируют слои в виде пчелиных сот толщиной один атом, в которых каждый атом углерода образует связи только с тремя своими соседями. Наиболее запоминающаяся черта этой структуры – абсолютно симметричные шестиугольники, образованные шестью атомами углерода в замкнутом контуре.
Если вы бухгалтер, то, наверное, сразу обратили внимание, что теперь у нас больше электронов, чем нужно для того, чтобы вставить по паре электронов между каждым атомом углерода, образуя таким образом химические связи в шестиугольных слоях. Каждый атом углерода в алмазе делился четырьмя электронами, по одному на каждую связь. То же упражнение, проделанное с графитом, оставляет нам один избыточный электрон на каждый атом углерода, после того как три других распределились по трем связям с соседними атомами.
Так что же делать с этими избыточными электронами?.. Было бы естественно подумать, что их можно использовать для того, чтобы связать вместе слои и образовать трехмерное вещество, которое мы можем взять в руки в виде реального куска графита, но дело обстоит иначе. Между слоями графита нет ничего, напоминающего химические связи. Вместо этого близкое расположение атомов углерода внутри слоев создает пространство сверху и снизу этих слоев, где избыточные электроны свободно перемещаются, внося свой вклад в образование связей в шестиугольниках. Это не те двойные связи, которые мы видели в главе 5; их называют делокализованными двойными связями , поскольку мы не можем точно указать, между какими именно атомами углерода находятся дополнительные электроны. Наличие таких освобожденных электронов приводит к возникновению электропроводности, и графит в самом деле отлично проводит электричество – при условии, что мы остаемся в рамках одного слоя.
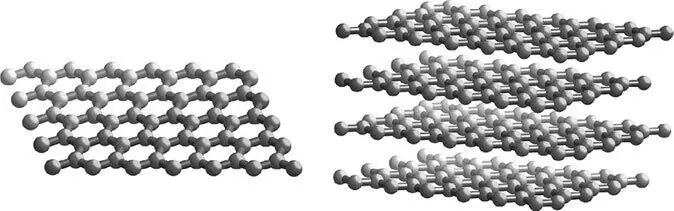
Рисунок 22.Небольшая часть слоя графита и расположенные друг над другом слои в кусочке кристаллического графита, похожего на тот, что добывали в шахтах Борроудейла.
Дополнительные связи также улучшают прочность слоев – но эти дополнительные электроны с большой неохотой помогают удерживать два слоя вместе: расстояние между слоями больше чем в два раза превышает расстояние между атомами углерода в слоях.
Еще одно важное свойство: теперь электроны можно перемещать при помощи видимого света, хотя моих коллег, возможно, огорчает такая терминология и они предпочли бы, чтобы я сказал, что электроны «возбуждаются». Поскольку электроны постоянно движутся или ведут себя скорее как волна с некоторой плотностью (представьте расплывчатое облако, окружающее ядра в атомах), то, возможно, лучше сказать, что они переключают передачу. Химики часто используют термин «скачок», описывая возбужденные электроны, особенно когда графически изображают это на бумаге в виде диаграмм. Для большинства веществ, способных поглощать видимый свет, существует лишь одна либо несколько избранных передач, каждое переключение между которыми требует собственного цвета, или длины световой волны. Эти цвета, условно говоря, поглощаются веществом и стираются из полного спектра белого света, а мы видим лишь оставшиеся цвета.
Однако графит обладает черным или темно-серым цветом с металлическим блеском, поэтому должен поглощать все длины волн приходящих фотонов. Следовательно, у него не может быть обычной коробки передач с пятью-шестью положениями; ему требуется постоянное переключение скоростей от низкоэнергетических красных цветов до высокоэнергетических оттенков, находящихся на границе с ультрафиолетом. Именно это происходит, когда избыточные электроны, не ограниченные одинарными углерод-углеродными связями в графите, могут свободно перемещаться в том, что фактически может рассматриваться как одна гигантская плоская молекула.
И наконец, эта самая плоская природа скажет последнее слово в ответе на вопрос, почему графит стал такой важной частью информационных технологий. Поскольку прочных связей, удерживающих слои графита вместе, не существует, можно относительно легко создать новые, более мощные силы притяжения, прижав графит к шероховатой поверхности. Тогда слои графита прилипнут к волокнам бумаги, и большие его куски останутся на ней, заполнив микроскопические впадины на бумаге. На карандашном рисунке мы видим не единичные слои: толщина этих линий составляет от нескольких сотен до нескольких тысяч слоев.
Читать дальше
Конец ознакомительного отрывка
Купить книгу













