(Можно, впрочем, дать радиационной «устойчивости» живого вещества и иное объяснение: жизнь на Земле возникла и развивалась на радиоактивном фоне, и поэтому установившийся уровень излучения является для всего живого на планете нормой, и мы, естественно, называем этот радиоактивный фон незначительным.)
Теперь попробуем «проникнуть в слов внутреннюю сущность». Космические лучи поглощаются молекулами газов, входящих в состав атмосферы, — так было сказано несколькими строками ранее. А что означает слово «поглощается»? Бессмысленно в данном случае обращаться, как это часто и правильно делают, к «Толковому словарю русского языка». Там мы найдем только, так сказать, физиологически-гастрономическое значение этого слова. А между тем, поглощать можно не только пироги.
Когда нашим телом «поглощаются» солнечные лучи, мы ощущаем вполне четкое физическое следствие — нагревание; нетрудно усмотреть и следствие химическое — загар.
Когда чувствительным слоем фотопленки поглощаются рентгеновы лучи, наступает распад молекул серебра и возникает изображение, «нарисованное» атомами металлического серебра.
Когда атмосферой поглощаются космические лучи, протекают ядерные реакции.
Космические лучи, сталкиваясь с атомами газов верхних слоев атмосферы, производят такое разрушительное действие, что из атомных ядер вылетают нейтроны. А где имеются свободные нейтроны, эти идеальные снаряды для атомной бомбардировки, там возникают ядерные реакции.
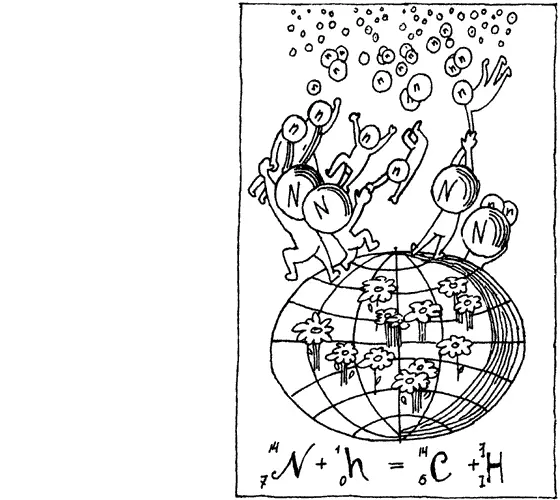
Заинтересуемся одной из них — захватом свободных нейтронов ядрами атомов азота. Сама реакция несложна:
H 14 7N + 1 0n = 14 6C + 1 1H
Нижние индексы — это порядковые номера химических элементов, или, говоря точнее, заряд ядра. Вот почему индекс при нейтроне — нуль. Именно нулю равен заряд нейтрона — нейтральной, незаряженной частицы. Как видим, сумма порядковых номеров частиц, вступающих в реакцию (7 + 0), равна сумме порядковых номеров продуктов этой реакции (6 + 1).
Верхние индексы — атомные массы участников ядерной реакции. И здесь, разумеется, сумма атомных масс атомов, вступивших в реакцию, строго равна сумме атомных масс продуктов реакции. Обращаю внимание на то, что углерод имеет не привычную для каждого, знакомого с азами химии, атомную массу 12, а 14. Таким образом, при этой ядерной реакции образуется тяжелый изотоп углерода. И все дело в том, что этот изотоп, углерод-14, радиоактивен. Он распадается, выбрасывая из ядра одну бета-частицу, и превращается при этом в азот. Период полураспада углерода-14 составляет 5570 лет. Запомните эту величину. Если не точно, то хотя бы приблизительно. Очень скоро она нам понадобится.
Установить факт образования в атмосфере радиоактивного изотопа углерода было делом физики. Для ответа на вопрос, что же происходит с этим углеродом дальше, следует обратиться к химикам.
Химия дает на этот вопрос быстрый и уверенный ответ. Образовавшийся из азота углерод-14 тотчас же соединяется с кислородом воздуха, образуя углекислый газ. Вот почему некоторая часть углекислого газа атмосферы радиоактивна. «Некоторая часть»? А какая именно?
Здесь вмешиваются геофизики. Они поясняют, что, судя по всему, интенсивность космического излучения не изменялась последние несколько миллионов лет. Поэтому можно быть уверенным, что за единицу времени — скажем, за год или десять лет, кому как удобнее считать, — в атмосфере образуется строго постоянное количество углерода-14. Ну, а поскольку величина периода полураспада тоже постоянна, и к тому же невелика сравнительно с геологическими периодами, то очевиден вывод, что содержание углерода-14 в атмосфере не изменяется.
Либби определяет точное содержание радиоактивного углерода в атмосфере. Он конструирует очень сложную установку для измерения слабой радиоактивности. Одно описание ее занимает 22 страницы убористого шрифта. Затем Либби принимается за измерение радиоактивности углекислого газа, добытого из атмосферы в самых различных областях нашей планеты и на самых разнообразных высотах.
Результаты опытов совпадают. В грамме обычного углерода, выделенного из углекислого газа, содержится такое количество углерода-14, которое дает за минуту 16 распадающихся атомов. Запомним и эту величину.
Для интересующихся замечу, что такое количество распадов указывает на ничтожно малое в весовом выражении содержание углерода-14 в обычном углероде, имеющем атомную массу 12. На грамм углерода-12 приходится одна десятимиллиардная доля грамма (10 -10грамма) углерода-14.
Читать дальше













