Количество точек в каждой зоне дает представление о вероятности найти в ней электрон в ходе нового эксперимента. Если бы нужно было предположить, в какой зоне будет находиться электрон 101-го атома, то мы однозначно остановились бы на одном из таких мест концентрации атомов. Это зоны, в которых |ψ|² достигает максимального значения. С уменьшением плотности точек функция тоже уменьшается; там, где точек нет вообще, функция равна нулю. Если бы мы проводили этот опыт с другими 100 атомами водорода с одинаковым уровнем энергии (но этот уровень отличался бы от уровня в предыдущем опыте), облака точек были бы организованы другим образом (рисунок 2).

РИС. 1

РИС. 2
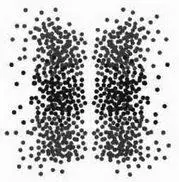

Благодаря ψ и |ψ|² эти данные можно представить в виде чисел. Мы уже знаем, что невозможно визуализировать ψ в трех измерениях; это же справедливо и для |ψ|². Чтобы представить часть информации, содержащейся в этих функциях, графически, обычно изображают облака точек или нечто подобное.
Технически термин «орбитальный» является синонимом волновой функции, но на практике он используется для описания этих представлений. Функции — решения уравнения Шрёдингера математически определяют контуры всех уровней энергии, на которых электрон может находиться в атоме водорода.
Любопытная деталь: существуют различные варианты форм орбиталей, однако их не бесконечное количество, скорее мы имеем дело с повторяющимися шаблонами, которые имеют разные размеры или другие незначительные отличия друг от друга. Все типы форм физики распределили по группам: s-орбитали соответствуют облакам со сферической симметрией; p-орбитали похожи на лопасти пропеллера; d- и f-орбитали состоят из множества лепестков и напоминают цветок. Буквенные обозначения соответствуют терминологии, которую используют спектроскописты: s — от sharp («резкий»), р — от principal («главный»), d — от diffuse («диффузный») и f — от fundamental («фундаментальный») (рисунок 3, стр. 125).
В функциях — решениях ψ также находят отражение квантовые числа n, m и l, как и в модели Зоммерфельда. Каждое из них означает определенный параметр, позволяющий смоделировать орбитали. Число / обозначает модель: l=0 соответствует s-орбитали; l = 1 соответствует р-орбитали; l = 2 — d-орбитали; l = 3 - f-орбитали. Число п дает представление о масштабе, то есть является ли орбиталь для данной модели большей или меньшей. Число т определяет ориентацию орбитали. Меняя эти параметры, в итоге получаем модель s-орбитали, трех р-орбиталей, пяти d-орбиталей и семи f-орбиталей, расположение которых будет зависеть от уровня энергии (рисунки 4 и 5).
По мере роста п увеличивается и энергия, и в каждой модели мы наблюдаем изменения, которые напоминают манипуляции продавца воздушных шариков, когда он скручивает свои шарики-колбаски, превращая их в маленькую собачку. Эти перегибы играют роль узлов на колеблющейся струне, и с ростом энергии их количество также увеличивается. В структуре атомов эти узлы обозначают зоны, в которых вероятность найти электрон равна нулю. Некоторые из этих частиц построены на основании радиальных функций, рассмотренных в предыдущей главе, и функции радиального распределения вероятностей Р(r) в рассматриваемой площади. Если бы мы решили рассмотреть различные орбитали во время описанного мысленного эксперимента со 100 атомами, то смогли бы увидеть узлы, совершив поперечное сечение облака распределения атомов: узлы соответствовали бы пустым зонам, свободным от точек (рисунок 6, стр. 126).
За исключением самых простых случаев (таких как атом водорода) листа бумаги и карандаша недостаточно для поиска решений уравнения Шрёдингера, поскольку это выражения, сформулированные с помощью известных функций, в которых участвуют различные переменные и постоянные показатели. Однако когда уравнение уже сформулировано, можно пойти путем приближений. Самое простое предположение, возможно, заключается в том, что атом, состоящий, например, из семи электронов, мы могли бы представить, накладывая друг на друга (словно слои в фотошопе) семь отдельных атомов водорода, причем состояние всех семи электронов отличалось бы.
Читать дальше