РИС.З
Орбиталь s Орбиталь р Орбиталь d Орбиталь f

РИС. 4
Три р-орбитали при n = 2 Три р-орбитали при n- 3
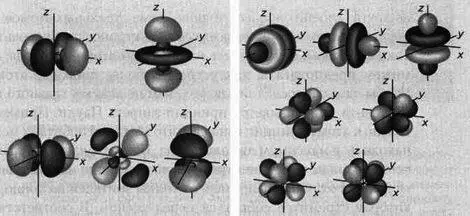
РИС. 5
Пять d-орбиталей при n = 3 Семь f-орбиталей при n = 4

РИС. 6
Облако и Р(r) для s-орбитали, n = 1 (0 узлов)
Облако и Р(r) для s-орбитали, n = 2 (1 узел)
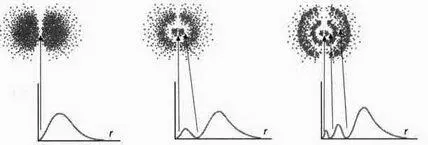
Облако и Р(r) для р-орбитали, n = 2 (1 узел)
Облако и Р(r) для р-орбитали, n = 3 (2 узла)
Облако и Р(r) для р-орбитали, n = 4 (3 узла)
Таким образом, основываясь на строении атома водорода, мы можем предполагать, как устроены более сложные атомы. Чтобы сделать последний штрих, нам не хватает главного ингредиента — им является принцип запрета Паули. Применительно к атому принцип означает, что на одной орбитали могут находиться максимум два электрона. Благодаря этому ограничению заряды не концентрируются на уровне минимальной энергии, в отличие, например, от толпы зрителей на концерте, которая стремится собраться перед сценой. В соответствии с принципом Паули заряды распределяются по энергетическим ступенькам, формируя таким образом структуру атома. Каждая s-орбиталь может принять два электрона, три р-орбитали могут принять шесть электронов, пять d-орбиталей — десять электронов и семь f-орбиталей — 14 электронов. По мере возрастания энергии количество орбиталей увеличивается, и атом становится похож на матрешку или луковицу. Химические свойства вещества определяются формой и содержимым орбиталей, расположенных ближе к внешнему краю. Конечно, описывая атом таким образом, мы несколько упрощаем: в реальности волновая функция атома из семи электронов является результатом взаимодействия частиц, а не механического наслоения семи независимых электронов.
Секрет химии
Зимним утром 1869 года русский химик Дмитрий Менделеев (1834-1907) записал на маленьких кусочках картона названия 63 элементов, известных в то время, а также коротко перечислил их главные характеристики. Оставляя некоторые места пустыми, он уложил эти кусочки картона в ряды и столбцы, и это расположение в общих чертах иллюстрировало периодическое повторение химических свойств элементов. При этом Менделеев эмпирическим путем смог подтвердить справедливость орбитальной модели. Каждая клетка таблицы содержит один элемент. Таблица читается слева направо и сверху вниз. Чтобы перейти от одной клетки к другой (от одного элемента к другому), достаточно прибавить к исходному элементу один протон и один электрон. Положительный заряд концентрируется в ядре, а отрицательный находится на орбиталях. Отправная точка — это водород, состоящий из одного электрона и одного протона; следующий элемент — это гелий, с двумя электронами и двумя протонами, и так далее. Нейтроны живут по своим собственным правилам. Электроны элементов одного столбца распределены на орбиталях, ближних к внешнему краю, одинаково.
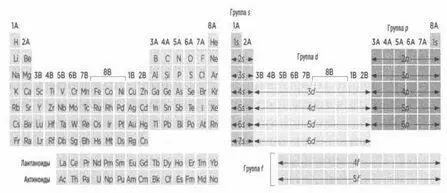
Периодическая таблица и орбитали.
Например, каждый элемент столбца 7А имеет пять электронов, распределенных по трем р-орбиталям, которые расположены ближе к внешнему краю. Речь идет о галогенах: фторе, хлоре, броме, йоде... Все эти элементы, несмотря на свои различия, имеют общие характеристики. Например, они очень летучи и легко могут отнять электрон у других элементов, чтобы пополнить свою р-орбиталь, на которой всегда находится одинокий электрон.
Модель наложения прозрачных контуров орбиталей можно расширить, добавив к ней другие атомы и соединив их с молекулами. Наложение атомных орбиталей позволяет увидеть молекулярные орбитали. В более точных вариантах приближения молекулярные орбитали являются результатом взаимодействия между всеми зарядами, а не обычного наложения независимых атомов.
Во время конференции, которая была организована до вручения Нобелевской премии и длилась несколько дней, Борн узнал, что большинство физиков приняли представленную им статистическую интерпретацию, но убедила она далеко не всех.
Читать дальше