Паули отказался от назначения квантовых чисел переходам между возможными электронными орбитами и переключился на присвоение каждому атомному электрону метки (сочетания трех квантовых чисел, которые использовали Бор и Зоммерфельд), установив, что в каждом атоме не может быть двух электронов с одной и той же меткой. Так, если в модели Бора — Зоммерфельда три квантовых числа относились к переходу энергии, эксцентриситету и прецессии возможных орбит вокруг ядра, то для Паули эти три квантовых числа были только величинами, которые применяются к каждому электрону. Понятие орбиты исчезло, но теоретические прогнозы совпадали с экспериментальными результатами.
ПРИНЦИП ЗАПРЕТА ПАУЛИ И ОРГАНИЗАЦИЯ ЭЛЕКТРОНОВ ПО ОРБИТАЛЯМ
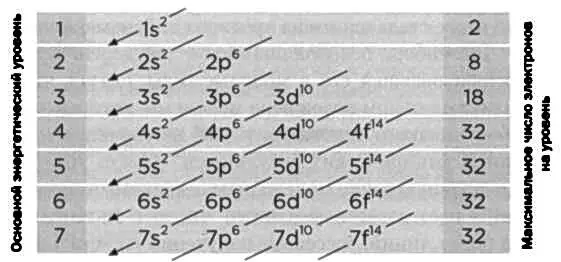
Представим себе атом с большим числом электронов. Как они распределяются вокруг ядра? Если отказаться от понятия орбиты, траектории электронов нарисовать уже нельзя, но, следуя постулатам новой квантовой механики, можно назначить им квантовые числа. Числа, косвенно отражающие уровни энергии. Любая физическая система стремится к состоянию наименьшей энергии. Если бы это было так, все электроны в стабильном атоме стремились бы к одному и тому же уровню, самому низкому. Принцип Паули запрещает именно это: не может быть двух электронов с одинаковыми квантовыми числами. Так электроны постепенно заполнят различные уровни (орбитали), начиная с самой низкой энергии. По этому правилу, орбитальная структура следует порядку стрелок на прилагаемом рисунке. Целые числа 1, 2, 3... представляют первое квантовое число, которое Бор ввел в 1913 году. Буквы s, р, d, f... представляют, в свою очередь, два квантовых числа, которые ввел Зоммерфельд: s изначально соответствовало круговой орбите; р — трем орбитам с одним и тем же эксцентриситетом, но с различными прецессиями; d — пяти орбитам, f— семи. Наконец, благодаря спиновому квантовому числу на каждой из этих орбиталей может быть по два электрона, один с положительным спином, а другой с отрицательным. Например, в случае с атомом меди, содержащим 29 электронов, его электронная конфигурация будет следующей:
1s 2, 2s 2, 2p 6, 3s 2, 3p 6, 4s 2, 3d 9.
Если сложить верхние индексы, мы увидим, что общее число электронов в сумме дает 29.
Единственная проблема, с которой столкнулся Паули, состояла в необходимости введения четвертого квантового числа, которое полностью объясняло эффект Зеемана, как нормальный, так и аномальный. Паули никак не истолковал это число, но двое молодых исследователей из Лейдена, Джордж Уленбек (1900-1988) и Сэмюэл Гаудсмит (1902-1978), решили, что это четвертое квантовое число можно считать четвертой степенью свободы электрона, чем-то вроде внутреннего вращения, аналогичного вращательному движению планет вокруг своей оси. По данной причине это четвертое атомное число было названо спином (от английского spin — «вращаться»).
Все вышесказанное подводит нас к принципу запрета Паули: в одной и той же системе, в одном и том же атоме каждый электрон должен отличаться от всех остальных; его четыре квантовых числа не могут совпадать. Это объясняет, например, что в самом низком состоянии энергии любого атома все электроны не могут находиться на первом орбитальном уровне, они распределяются по возрастающим уровням энергии и квантовым числам.
Гейзенберг развил этот новый ход мысли до конца. Речь не только о том, чтобы забыть об орбитах электронов в атомах, но и о том, чтобы перестать думать о траекториях в целом и даже о классическом понятии частицы как чего-то ограниченного в пространстве. Значительная часть новой механики была сформулирована Гейзенбергом во время отпуска на Гельголанде, маленьком острове в Северном море. Его формулировка в итоге стала одним из предложений, изменивших физику.
Гейзенберг, освободившийся от неуверенности в себе, характеризовавшей его в молодые годы, сказал, что квантовая физика слишком осложнена моделями, которые не имеют под собой никакого основания и уже не справляются с предсказанием эмпирических результатов. Вместо того чтобы брать за отправную точку модели, нам незнакомые, лучше взять действительно известные данные: число и интенсивность спектральных линий, рассеяние излучений и света или любое другое явление, связанное с электронами и излучениями. И Гейзенберг, будто нумеролог или каббалист, принялся организовывать данные энергии и интенсивности по рядам и столбцам. Так он заметил, что складываются любопытные повторяющиеся математические отношения, которые позволяют ему с относительной легкостью оперировать эмпирическими данными.
Читать дальше