p = nmv 2/6V
где n — число молекул газа. Из этого уравнения следовали газовые законы. Но работа Крёнига была далеко не безупречной. Ошибочными были коэффициент 1/6 в формуле для давления и утверждение о прямолинейности распространения частиц газа, да еще с «известными и постоянными» скоростями. Не было ясно, как вычислять значения входящего в формулу квадрата скорости молекул v 2. Формулой Крёнига, по сути, пользоваться для конкретных расчетов было невозможно. Однако стоит обратить внимание на то, что Крёниг первым высказал мысль о необходимости привлечения в молекулярно-кинетическую теорию вероятностных представлений, ибо «траектория каждого атома настолько беспорядочна, что не поддается никакому расчету».
Уже в следующем 1857 г. другой немецкий физик Р. Клаузиус (1822-1888) опубликовал большую работу по кинетической теории газов. Он уточнил вывод Крёнига и получил уравнение, известное теперь школьникам под названием основного уравнения молекулярно-кинетической теории:
p = nmv 2/3V. (6)
Клаузиус впервые вычислил скорости молекул газа. Например, для скорости молекул кислорода при нормальных условиях он получил v = 461 м/с, для водорода — 1844 м/с. Эти результаты вызвали большие сомнения, поскольку они противоречили известным фактам медленного распространения по комнате, например, запаха цветов и т. п. Клаузиус увидел разгадку кажущегося противоречия в столкновении частиц газа между собой и впервые ввел в физику газов важнейшее понятие средней длины свободного пробега как пути, проходимого частицей газа между двумя последовательными столкновениями. И хотя сам Клаузиус не смог рассчитать эту длину, благодаря его трудам картина движения молекул в газах существенно изменилась — траектория молекул из-за столкновений является чрезвычайно запутанной, изломанной (рис. 3). Даже небольшой путь в определенном направлении частицы проходят за довольно большое время (это и объясняет малую скорость процессов диффузии в газах при значительных скоростях движения отдельных молекул).

Рис. 3. Траектории молекул в газах
Клаузиус уточнил представления Крёнига о молекуле как об упругом шарике и дополнил картину тем, что, помимо чисто поступательного движения, молекулы могут обладать и внутренним движением — составляющие молекулу атомы могут колебаться относительно своих равновесных положений, молекула в целом может вращаться (рис.4). Время «фантазий» в физике еще не кончилось! Клаузиус предположил равномерное распределение энергии между различными движениями. (Теперь говорят о равномерном распределении энергии между различными степенями свободы, причем под их числом понимают число независимых между собой возможных перемещений системы. Так, для атома оно равно 3, что соответствует независимым перемещениям вдоль 3-х координатных осей — x , y и z. Для молекул число степеней свободы увеличивается за счет появления колебательного и вращательного движений.)
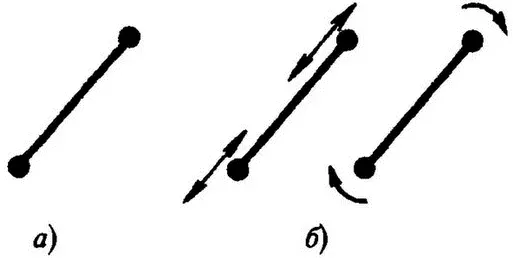
Рис.4, а) Механическая модель молекулы; б) колебательное и вращательное движения молекулы
Работы Клаузиуса имели важное направляющее значение для дальнейших исследований, и очень скоро
«…из количественных экспериментов нал вязкостью Максвелл определил, что в воздухе при нормальных условиях каждая молекула газа сталкивается с другими 5 тысяч миллионов раз в секунду и что путь, пройденный молекулой между двумя последовательными столкновениями (так называемая средняя длина пробега), примерно равен десятитысячной доле миллиметра».
Используя эти данные, австрийский ученый И. Лошмидт в 1865 г. впервые вычислил размеры молекул воздуха и их число в объеме 1 м 3при нормальных условиях. Это число получило впоследствии название числа Лошмидта:
n Л= 2,1∙10 25м -3.
«Значение числа Лошмидта выхолит далеко за пределы теории газов. Оно позволяет глубоко заглянуть в самую природу и дает ответ на вопрос о непрерывности материи. Когда мы имеем каплю волы объемом в 1 мм 3, то опыт показывает, что мы можем разделить ее на лее части, и каждая из них тоже является водой. Каждую из этих частей можно снова разделить на лее части. Число Лошмидта указывает нам пределы этой делимости. Когда мы разделим нашу каплю на триллион равных частей, то дальнейшее деление на одинаковые части становится невозможным. Мы получим индивидуальные части, о точных свойствах которых мы, правда, очень мало знаем. Мы полагаем, что их можно делить и дальше, но это деление совсем другое. Разделенные части уже не будут подобны имевшейся прежде воле».
Читать дальше














