Если вас не удовлетворит и это доказательство, то можно придумать искусственный пример, когда равновесие обеспечивается устройством, по которому молекулы каждого газа бьют с обеих сторон. Предположим, что сквозь поршень проходит короткий стержень, на концах которого насажено по шару. Стержень может двигаться сквозь поршень без трения. По каждому из шаров со всех сторон бьют молекулы одного сорта. Пусть масса нашего устройства равна m, а массы молекул газа, как и раньше, равны m 1и m 2. В результате столкновений с молекулами первого сорта кинетическая энергия тела массы m равна среднему значению 1/ 2 m t v 1 2(мы уже доказали это). Точно так же, столкновения с молекулами второго сорта заставляют тело иметь кинетическую энергию, равную среднему значению 1/ 2 m 2 v 2 2. Если газы находятся в тепловом равновесии, то кинетические энергии обоих шаров должны быть равны . Таким образом, результат, доказанный для случая смеси газов, можно немедленно обобщить на случай двух разных газов при одинаковой температуре.
Итак, если два газа имеют одинаковую температуру, то средние кинетические энергии молекул этих газов в системе центра масс равны .
Средняя кинетическая энергия молекул — это свойство только «температуры». А будучи свойством «температуры», а не газа , она может служить определением температуры. Средняя кинетическая энергия молекулы, таким образом, есть некоторая функция температуры. Но кто нам подскажет, по какой шкале отсчитывать температуру? Мы можем сами определить шкалу температуры так, что средняя энергия будет пропорциональна температуре. Лучше всего для этого назвать «температурой» саму среднюю энергию. Это была бы самая простая функция, но, к несчастью, эту шкалу уже выбрали иначе и вместо того, чтобы назвать энергию молекулы просто «температурой», используют постоянный множитель, связывающий среднюю энергию молекулы и градус абсолютной температуры, или градус Кельвина. Этот множитель: k =1,38·10 -23 дж на каждый градус Кельвина [29] Стоградусная шкала— это шкала Кельвина, в которой за нуль принята температура 273,16°, так что T=273,16+стоградусная температура.
. Таким образом, если абсолютная температура газа равна Т , то средняя кинетическая энергия молекулы равна 3/ 2 kT (множитель 3/ 2введен только для удобства, благодаря чему исчезнут множители в других формулах).
Заметим, что кинетическая энергия, связанная с составляющей движения в любом направлении, равна только 1/ 2k Т . Три независимых направления движения доводят ее до 3/ 2 kT .
§ 5. Закон идеального газа
Теперь можно подставить наше определение температуры в уравнение (39.9) и найти закон зависимости давления газа от температуры: произведение давления на объем равно произведению полного числа атомов на универсальную постоянную k и температуру:
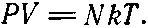 (39.22)
(39.22)
Следовательно, при одинаковых температуре, давлении и объеме число атомов строго определено — это тоже универсальная постоянная! Таким образом, из законов Ньютона следует, что в равных объемах любых газов при одинаковых температуре и давлении содержится равное число молекул. Вот какой неожиданный вывод!
На практике, когда имеешь дело с молекулами, приходится оперировать большими числами, поэтому химики произвольно выбрали число, очень большое число, и придумали ему специальное название. Они назвали его моль . Моль — это очень искусственное число. Почему химики не приняли за единицу 10 24, чтобы вышло круглое число,— это вопрос исторический.
Случилось так, что они для удобства выбрали стандартное число N 0=6,02·10 23объектов и назвали это число молем объектов. После этого, вместо того чтобы измерять число молекул в штуках, они измеряют их в молях [30] То, что химики называют молекулярным весом, есть не что иное, как масса моля молекул в граммах. Моль определяется так, что масса моля атомов изотопа углерода 12 (ядра которого состоят из 6 протонов и 6 нейтронов) равна в точности 12 г.
. Можно написать число молей (выражая их через N 0) и умножить его на число атомов в моле, потом умножить на kT , а затем, если захотим, выделить произведение числа атомов в моле на k, тогда получится молярное значение k; для этой величины выделим особую букву R . Молярное значение k равно 8,317 дж : R = N 0 k =8,317 дж / моль ·К -1. Таким образом мы нашли газовый закон, выраженный в виде произведения числа молей (его обозначают буквой N ) на RT , или в виде произведения числа атомов на kT :
Читать дальше

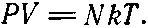 (39.22)
(39.22)




