Даже приведенные примеры не могут окончательно доказать, что атомы действительно существуют. По крайней мере один из выдающихся химиков прошлого столетия утверждал свое право не верить в них, пока, практически только в начале нашего века, эксперименты с атомными частицами (броуновское движение, опыты Милликена по измерению заряда е электрона и отношения заряда к массе e / m электронов и ионов, а также опыты по рассеянию альфа-частиц) не заставили признать атомы безусловно необходимыми для описания материи.
Мы далеки от утверждения, что простым взвешиванием можно измерить относительные массы отдельных атомов. Но как же узнать, в 8 или 16 раз масса атома кислорода больше, чем водорода? Широко известное соединение углерода и водорода — газ метан — содержит их в весовом соотношении 3:1. Можно ли записать метан в виде СН, сказав, что углерод только в 3 раза тяжелее водорода? Химики считают, что на самом деле формула метана СН 4, т. е. соотношение между углеродом и водородом следует записать (4x3):(4х1) = 12:4, иначе говоря, углерод в 12 раз тяжелее водорода. Как удалось сделать такое важное заключение? Эта задача была решена с помощью хитроумного химического приема. Метан был обработан хлором, который заместил в нем водород. Если бы метан содержал по одному атому С и Н, то он превратился бы в ССl. Если же метан — это СН 4, то в нем можно заменить на хлор 1, 2, 3 или даже 4 водородных атома. И в самом деле, действием хлора на метан были получены четыре различных химических соединения. Первое — тяжелый газ СН 3Сl, второе — еще более тяжелый газ СН 2Сl 2, затем жидкость СНСl 3(хлороформ) и, наконец, ядовитая жидкость — четыреххлористый углерод ССl 4.
Вот как распределяются весовые пропорции между элементами в этих веществах:
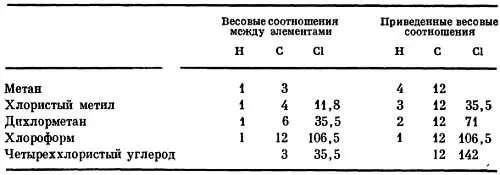
Как только вы разберетесь в этих соотношениях и приведете их к виду, который изображен в правой части таблицы, вам станет ясно, что масса атома углерода должна быть в 12 раз больше массы атома водорода. (Если, конечно, в действительности формула метана СН 8, то атом углерода будет тяжелее не в 12, а в 24 раза. Однако в этом случае можно было бы ожидать появления еще и других хлорзамещенных метана, таких, скажем, как СН 7Сl, которые в действительности не обнаруживаются. Имеются и другие убедительные доказательства, подтверждающие правильность выбора значения 12.)
Вернемся теперь опять к воде. Если ее формула НО, то отношение масс атомов водорода и кислорода 1:8. Почему же мы должны считать, что вода — это Н 2О, т. е. что атом кислорода в 16 раз тяжелее атома водорода. Когда впервые было обнаружено, что вода содержит кислород и водород, ей как раз и приписали состав НО. Эта ошибка была исправлена только с появлением закона Авогадро, что в значительной степени помогло атомной химии прийти к ее современному состоянию.
Объемы газов и химические превращения
Современные методы взвешивания и точные расчеты показывают, что массы элементов относятся приблизительно как целые числа. Однако в прежние времена более легким и очевидным количественным методом было измерение объема газов. Если мы соединим водород и кислород при температуре, скажем, 100 °C и будем поддерживать образующуюся при этом воду в виде пара, то обнаружим, что 2 л водорода соединяются с 1 л кислорода, образуя 2 л пара, или 1 л хлора и 1 л водорода дают 2 л газообразной соляной кислоты, или при горении 2 л окиси углерода расходуется 1 л кислорода и получаются 2 л двуокиси углерода.
Можно привести десятки подобных примеров простых соотношений между объемами реагирующих газов. (Конечно, все измерения должны производиться при постоянной температуре и одном и том же давлении, скажем при давлении, равном атмосферному.)
Закон Авогадро
Вскоре после того, как Гей-Люссак указал на то, что объемы вступающих в реакцию газов подчиняются простым соотношениям, итальянский ученый Амадео Авогадро высказал блестящую догадку (~ 1813 г.), что (при любых выбранных температуре и давлении) равные объемы различных газов содержат одинаковое число молекул, т. е. независимо от сорта газа в одном и том же сосуде содержится равное число молекул. Авогадро так убедительно аргументировал свои мысли, что если бы вы прочитали его записи, то сочли бы заключения, сделанные им, неопровержимыми. Данные современной физики (см. гл. 30 ) полностью подтверждают правоту ученого, и мы называем этот закон законом Авогадро .
Читать дальше











