Другое, знакомое нам превращение:
CO 2+ H 2 O= H 2 CO 3.
[Одна молекула углекислого газа при растворении соединяется с одной молекулой воды, образуя молекулу угольной кислоты.]
Мы помним также, что Н 2СО 3может расщепляться на ионы водорода Н +, Н +и ион СО 3, т. е. СО 3 -:
H 2 CO 3 H ++ H ++ CO 3 -
При сливании растворов хлористого натрия и угольной кислоты смесь остается совершенно прозрачной, а при смешивании растворов углекислого натрия Na 2CO 3и хлористого кальция СаСl 2мы видим облачко осаждающегося мела:
Na 2 CO 3+ СаСl 2= СаСО 3+ 2 NaCl [86].
Зная, что растворенные вещества могут расщепляться на ионы, осторожный химик написал бы такое уравнение для электрически заряженных ионов и заменил бы знак равенства «=» стрелками 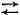 , которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО 3нерастворима, то поставил бы только одну стрелку;
, которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО 3нерастворима, то поставил бы только одну стрелку;
Na 2 CO 3+ CaCl 2—> CaCO 3+ 2 NaCl.
Возьмем теперь наш только что полученный мел СаСО 3 и прокалим его;
CaCO 3 CaO+ CO 2
[мел превращается в известь и углекислый газ].
Здесь стрелки направлены в обе стороны, так как реакция может идти в любом направлении в зависимости от температуры. Растворяясь в воде, известь образует раствор гидроокиси кальция:
CaO+ H 2 O—> Ca( OH) 2
Гидроксильная группа ОН входит в состав самых едких щелочей, хотя сама известковая вода обладает весьма слабыми щелочными свойствами. Опустим в воду небольшой кусочек металлического натрия, и он вырвет атом водорода из молекул этой нейтральной жидкости, образуя сильную щелочь:
Na+ H 2 O—> NaOH+ H
[натрий и вода дают гидроокись натрия и водород].
Выделяющиеся пузырьки газообразного водорода говорят нам о том, что нужно удвоить это уравнение и записать его в виде
2 Na+ 2 Н 2 О—> 2 NaOH+ Н 2.
Гидроокись натрия (каустическая сода, или едкий натр) — это мыльный на ощупь, едкий щелочной раствор, нейтрализующий кислоты
2 NaOH+ H 2 SO 4 —> Na 2 SO 4+ Н 2 О.
[Гидроокись натрия (каустическая сода) + серная кислота (сернокислый водород) дают сернокислый натрий и воду.]
Кислоты
Все кислоты содержат водород и неметаллические элементы (хлор в соляной кислоте, сера и кислород в серной). Для кислот характерно, что входящие в них атомы водорода в водном растворе становятся ионами Н +, придавая ему кислый вкус. (В растворах щелочей в противоположность этому образуются ионы ОН -.)
Распознавать кислоты по их кислому вкусу все же опасно, лучше познакомиться с их другими свойствами. Кислоты способны нейтрализовать щелочи, образуя воду и выделяя тепло. Они реагируют со многими металлами, которые замещают в них водород. Большинство кислот вытесняет углекислый газ из растворов карбонатов.
Мы можем непосредственно получить соляную кислоту, смешивая равные объемы водорода и тяжелого зеленоватого газа хлора или беря их в весовой пропорции 2:71 и вызывая взрывную реакцию с помощью вспышки ультрафиолетового света:
Н 2+ Сl 2—> 2 HCl
[водород + хлор образуют при взрыве пары хлористого водорода, или гидрохлорида].
Хлористый водород — легко растворяющийся в воде газ, образующий концентрированные растворы с очень кислым вкусом. Обычная соляная кислота и есть раствор хлористого водорода. Она широко применяется в химической промышленности и участвует в пищеварении человека.
Простейший способ получения углекислого газа в лабораторных условиях — подействовать соляной кислотой на мел:
CaCO 3+ 2 HCl—> СаСl 2+ Н 2 О+ СО 2.
Если продувать СО 2через раствор едкого натра, то последний реагирует с ним с образованием карбоната. (Если хотите, можно сказать, что СО 2дает угольную кислоту Н 2СО 3, которая затем нейтрализует щелочь NaOH.)
2 NaOH+ CO 2 —> Na 2 CO 3+ H 2 O.
Серную кислоту можно получить из минеральной необработанной серы:
S+ O 2—> SO 2
[сера при сгорании образует двуокись серы]
Читать дальше

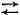 , которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО 3нерастворима, то поставил бы только одну стрелку;
, которые означают, что процесс может протекать в обоих направлениях. Но если бы он заметил, что одна из четырех комбинаций СаСО 3нерастворима, то поставил бы только одну стрелку;








