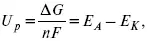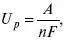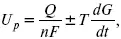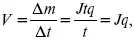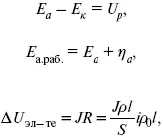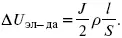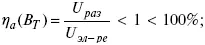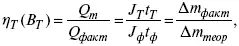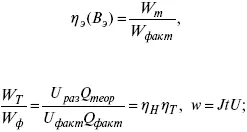Термодинамические показатели
К термодинамическим показателям относятся те, которые можно рассчитать, используя законы термодинамики, исходя из условий, что система находится в равновесии. Напряжение разложения:
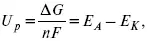
где Δ G – изменение термодинамического потенциала;
п – число электронов, участвующих в химической реакции;
F– число Фарадея.
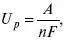
где А – максимальная работа, которую способна совершить система в равновесном состоянии.
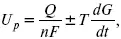
где Q – тепловой эффект реакций;
U p – термодинамическая характеристика электрохимической системы, которая мало зависит от условий электролиза.
Отклонение системы – поляризация. Электрохимическая реакция является гетерогенным процессом, и ее скорость может лимитироваться одной из стадий:
1) подвод реагирующего вещества к границе раздела фаз;
2) разряд и ионизация;
3) отвод продуктов реакции.
Поляризация, определяемая медленной стадией массопереноса – концентрационная. Если медленной стадией является стадия разряда ионизации, то поляризация называется перенапряжением. Природа и значение поляризации зависят от многих факторов: природа реагирующего вещества, материал электрода, состояние поверхности электрода, плотность тока, состав раствора и режим электролиза. Кинетический параметр– параметр, определяемый в реальных условиях электрохимической системы: ρ тока, Е АКТИВ , коэффициент диффузии, коэффициент переноса α (на катод), β (на анод) – доля расхода на процесс:
1) сила тока в электрохимическом аппарате J= i KS едзагрузки, A, Z, i K– в зависимости от электролита;
2) скорость электролиза – образование массы вещества за единицу времени
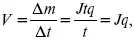
где q – электрохимический эквивалент, v электролиза – J тока,
если в 1 см 2 – v – i тока.
Баланс напряжений.Напряжение на электрохимическом аппарате определяет расход электроэнергии при электролизе. Баланс напряжений на электрохимическом аппарате складывается из следующих составляющих:
U ЭЛ-РЕ = Е a– Е k+ η a+ η k, + Δ U ЭЛ-ТА+ Δ U ДИФ+ Δ U КОН+ Δ U ЭЛ,
где Е a– обратимый потенциал анода, В;
Е К– обратимый потенциал катода, В;
η a– поляризация анода, В;
η k– поляризация катода, В;
Δ U ЭЛ-ТА– падение напряжения в электролите, В;
Δ U ДИФ – падения напряжения в диафрагме, В;
Δ U КОН – падение напряжения в контактах, В;
Δ U ЭЛ– падение напряжения в электродах, В.
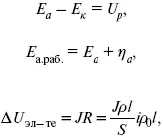
где i – плотность катодного тока;
ρ 0– удельное сопротивление электролита, ρ 0повышается при вводе газа;
l – расстояние между электродами;
S – площадь сечения электролита;
J – электропроводность.
Коэффициент газонаполнения k = ρ/ρ 0 .
Падение напряжения газозаполнения элемента определяется по формуле
Δ U ЭЛ-ТА= ilρ 0 k.
Падение напряжения в диафрагме
Δ U ДИФ= JR ДИАФ .
Падение напряжения в контактах обычно принимают равным 5 – 10% от общего напряжения.
Падение напряжения в электродах:
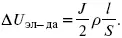
Снижение напряжения на электрохимическом аппарате – оптимальное расстояние между электродами, максимальной электропроводностью.
Рис. 2
К энергетическим характеристикам относятся:
1) напряжение на электрохимическом аппарате;
2) отдача по напряжению.
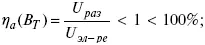
3) отдача по емкости
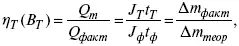
4) отдача по энергии
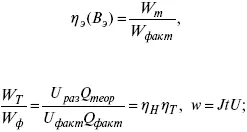
5) производительность электрохимического аппарата оценивается количеством продукта на одной затраченной энергии.
Читать дальше
Конец ознакомительного отрывка
Купить книгу