Изучение горения лучше всего начать с какого-нибудь простого случая. Свеча для этого нам не годится - слишком много побочных факторов сопутствуют химической реакции горения. Топливо сначала должно расплавиться, затем подняться по фитилю, испариться и лишь потом, смешавшись с кислородом воздуха, сгореть. Вспомним слова Фарадея: "Как можно что-нибудь изучать, когда мешают трудности, не относящиеся к делу?"
Целесообразно начать с горения газов. Это связано с тем, что газовые химические реакции лучше изучены, чем реакции в конденсированных телах или на их поверхности. Кроме того, и многие физические процессы (теплопроводность, диффузия) в газовых системах мы можем рассчитывать лучше, чем в твердом теле или жидкости.
Пусть в некотором сосуде находится смесь газов, способная к экзотермической реакции. Если температура газа достаточно низка (например, комнатная), то лишь небольшая доля молекул может вступить в химическую реакцию. Для многих горючих смесей скорость реакции при комнатной температуре столь ничтожна, что они могут сохраняться очень долго. Повысим теперь температуру газа - возрастет скорость химической реакции, а вместе с нею и скорость выделения тепла. Это приведет к дальнейшему, уже самопроизвольному нагреву газа за счет его химической энергии.
Если бы не было потерь энергии через стенки сосуда, то произошел бы, как обычно говорят, тепловой взрыв. Повышение температуры вело бы к росту скорости химической реакции, а рост скорости реакции к увеличению температуры. Скорость этого процесса очень быстро возрастает во времени, так что он носит взрывной характер. Повышение температуры газа после завершения реакции пропорционально тепловому эффекту.
При учете потерь энергии газа через стенки сосуда могут осуществиться два случая. Если размеры сосуда достаточно велики, то теплопотери малы по сравнению с тепловыделением за счет химической реакции. Действительно, скорость выделения энергии пропорциональна объему сосуда, т.е. кубу его линейного размера, а теплопотери-поверхности, которая пропорциональна квадрату линейного размера.
Увеличение объема сосуда снижает роль теплопотерь. Взрыв будет происходить, но менее бурно, чем в неограниченном сосуде. Если же роль теплопотерь велика (небольшой объем газа), то взрыв не успеет развиться - после некоторого повышения температуры газа устанавливается стационарный режим, при котором тепловыделение равно теплопотерям и реакция идет с почти постоянной, обычно малой, скоростью.
Необходимо отметить, что переход от невзрывного, медленного протекания реакции ко взрыву носит резкий характер. Достаточно лишь на немного увеличить размер сосуда или температуру окружающей среды, как течение реакции радикально меняется. Это один из примеров существования критических условий в горении.
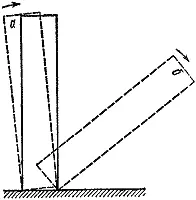
Рис. 3
Можно привести много примеров критических условий. Самые наглядные и понятные из них механические. Поставим на стол кость от домино (рис. 3). Если наклонить ее на угол, меньший некоторого, то предоставленная самой себе она вернется в начальное положение ( а). В противном случае исход опыта будет совсем иным ( б).
Читатели, знакомые с принципом действия атомного реактора, вспомнят, конечно, что там критические условия связаны с равенством скорости выделения нейтронов в объеме реактора и скорости их поглощения и вылета из реагирующей среды.
Есть критические условия и в животном мире. Чем крупнее животное, тем меньше у него отношение поверхности тела к его объему. У небольших животных потеря тепла на единицу массы очень велика, поэтому нужна очень высокая интенсивность обмена веществ. Это обстоятельство ставит предел уменьшению размеров тела теплокровного животного. Если человеку для поддержания жизни достаточно в сутки потреблять количество пищи, составляющее процент от его массы, то самое мелкое млекопитающее (землеройка массой три-пять граммов должно ежесуточно поглощать количество пищи, равное массе животного.
В рассмотренной выше постановке опыта скорость химической реакции почти постоянна по объему сосуда, поэтому тепловой взрыв охватывает весь газ. Представим теперь, что в достаточно широкой трубе находится смесь газов Аи В, которые могут реагировать с выделением некоторого количества тепла Q :
Читать дальше
Конец ознакомительного отрывка
Купить книгу






![Майкл Муркок - История Рунного посоха [4 книги - Голова с камнем; Амулет Безумного Бога; Меч Рассвета; Рунный посох]](/books/391676/majkl-murkok-istoriya-runnogo-posoha-4-knigi-golo-thumb.webp)
![Майкл Азеррад - Come as you are - история Nirvana, рассказанная Куртом Кобейном и записанная Майклом Азеррадом [litres]](/books/392533/majkl-azerrad-come-as-you-are-istoriya-nirvana-ra-thumb.webp)



