Молекулы довольно неохотно поддаются расщеплению на атомы. Возьмем, к иримеру, обыкновенный лед. Его молекула содержит два атома водорода и один атом кислорода. Нагревая лед, его можно расплавить и превратить в воду. Вода будет состоять из тех же молекул. При кипячении воды она испаряется, но и пары воды-это те же самые молекулы. Лишь нагревая водяные пары до очень высокой температуры (несколько тысяч градусов), можно разрушить молекулы и получить отдельные атомй водорода и кислорода.
При дальнейшем повышении температуры и атомы разлагаются на их составные части -положительные ядра и отрицательные электроны. Таким образом, атомы в молекуле связаны между собой довольно мощными силами.
Голландский физик Ван-дер-Ваальс, исследуя поведение плотных газов при различных температурах и давлениях, установил, что для объяснения их свойств необходимо предположить существование сил притяжения между молекулами на больших расстояниях и отталкивание на малых.
Причину возникновения межатомных и межмолекулярных сил можно понять лишь на основе квантовой механики - науки, описывающей поведение микрочастиц. Не останавливаясь на подробностях, укажем лишь, что эти силы имеют электрическую природу. Однако для расчета межатомных взаимодействий недостаточно одного известного закона Кулона. Квантовый характер движения электронов приводит к специфическим особенностям взаимодействия атомов по сравнению со взаимодействием обычных классических заряженных частиц.
Если на больших расстояниях атомы притягиваются, а на малых отталкиваются, то должно быть положение, где сила взаимодействия между атомами равна нулю (силы притяжения при уменьшении расстояния в этой точке сменяются силами отталкивания). Это так называемое положение равновесия. Поместив два атома на таком расстоянии, мы получим устойчивую молекулу. Действительно, при малейшем изменении расстояния между атомами возникают силы, стремящиеся вернуть эти атомы в исходное состояние (если расстояние увеличилось, то появляются силы притяжения, которые вызывают сближение атомов; при случайном уменьшении расстояния возникнут силы отталкивания).
В физике обычно говорят не на языке сил, а на языке энергий. Это оказывается во многих случаях удобнее. Например, при изучении движения тел в поле тяжести Земли вместо закона тяготения Ньютона часто пользуются понятием потенциальной энергии. Величина потенциальной энергии тела в поле Земли зависит от высоты, на которую оно поднято. Чем больше расстояния от Земли, тем большую работу совершает тело при падении и тем, следовательно, больше его потенциальная энергия. На поверхности Земли потенциальная энергия меньше всего.
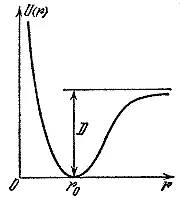
Рис. 1
Те же рассуждения можно применить и к молекулам. Раздвинутые на большое расстояние атомы обладают потенциальной энергией, так как они притягиваются. Точно так же из-за сил отталкивания имеется потенциальная энергия и у атомов, которые сблизились на расстояние меньше равновесного. Минимальная потенциальная энергия - у атомов, находящихся в положении равновесия. На рис. 1 изображена типичная кривая, показывающая, как изменяется потенциальная энергия в зависимости от расстояния между атомами. Точка r о отвечает положению равновесия атомов. Видно, что при отклонении от этого положения энергия быстро растет. Если сначала атомы находились в точке r о , то для удаления их друг от друга на большое расстояние нужно затратить энергию, равную D. При этом из молекулы мы получим два изолированных атома. D- энергия связи атомов в молекуле, или энергия связи молекулы.
Здесь уместно провести аналогию с механикой. Если некоторое тело, находящееся в поле тяжести, движется по поверхности, изображенной на рисунке, то его потенциальная энергия будет изменяться подобным же образом. Шарик всегда скатывается в углубление, и чтобы достать его оттуда, нужно затратить некоторую энергию, пропорциональную глубине ямы.
При химическом взаимодействии происходит превращение одних молекул в другие. При этом разрушаются старые связи и возникают новые. Рассмотрим в качестве примера реакцию между молекулами Аи В(исходные вещества), которая приводит к образованию Ки L(молекулы-продукты):
Читать дальше
Конец ознакомительного отрывка
Купить книгу






![Майкл Муркок - История Рунного посоха [4 книги - Голова с камнем; Амулет Безумного Бога; Меч Рассвета; Рунный посох]](/books/391676/majkl-murkok-istoriya-runnogo-posoha-4-knigi-golo-thumb.webp)
![Майкл Азеррад - Come as you are - история Nirvana, рассказанная Куртом Кобейном и записанная Майклом Азеррадом [litres]](/books/392533/majkl-azerrad-come-as-you-are-istoriya-nirvana-ra-thumb.webp)



