Существуют также решения, не обладающие сферической симметрией, в которых облака электронной вероятности сконцентрированы в областях, находящихся в разных местах по отношению к ядру, а не распределены однородно вокруг него. Нам необходимо знать о трех типах орбиталей, показанных на рис. 5.6. Орбитали, в которых вероятность собрана в две области, называются p -орбиталями, орбитали с четырьмя областями называются d -орбиталями, а орбитали с шестью областями называются f -орбиталями. Благодаря тому, что плотность тени, изображающая вероятность нахождения электрона в данном месте, меняется, когда мы, по пути измеряя ее, движемся по кругу вокруг ядра, p -, d - и f -орбитали соответствуют состоянию с ненулевым моментом импульса электрона, который они описывают, причем d -орбитали соответствуют более высокому моменту импульса, чем p- орбитали, а еще более искривленные f -орбитали соответствуют еще более высокому моменту импульса. Момент импульса является источником центробежной силы, которая отбрасывает электрон от ядра. Есть еще один незначительный технический момент, который скоро приобретет огромное значение: в результате такого центробежного эффекта в любой из этих орбиталей никогда нельзя обнаружить электрон возле самого ядра.
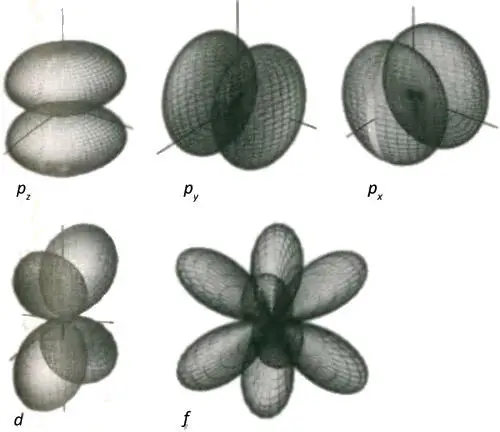
Рис. 5.6.Двудольное распределение плотности вероятности нахождения электрона (изображенное в виде граничной поверхности) является характерным для p -орбитали, четырехдольное распределение характерно для d -орбитали, а шестидольное для f -орбитали. Поскольку орбитали последовательно становятся все более искривленными (то есть соответствуют волнам обращения вокруг сферы с более короткой длиной), соответствующий им момент импульса электрона возрастает. Ни в одной из этих орбиталей не существует вероятности нахождения электрона непосредственно у самого ядра: он все больше отбрасывается от ядра по мере возрастания момента импульса.
Нам необходимо узнать еще два свойства решений, которые Шредингер получил для своего уравнения. (Я прошу прощения за эту прелюдию, но вскоре она покажется весьма уместной.) Во-первых, посмотрим на энергетическую схему, изображенную на рис. 5.7. Мы видим, что с возрастанием энергии все большие группы орбиталей становятся допустимыми, потому что чем выше частоты и чем более искривлены пути возможных колебаний сферы, тем серьезнее может искажаться ее форма. При самой низкой энергии допустима только одна орбиталь, s -орбиталь на рис. 5.5. На следующем уровне допустимы одна s -орбиталь и три p -орбитали. На следующем, еще более высоком, уровне имеются одна s -орбиталь, три p -орбитали, 5 d -орбиталей и так далее. В этой схеме нет ничего магического, это просто схема решений уравнения Шредингера для атома водорода. Группы энергетических уровней называются электронными оболочками , потому что орбитали, принадлежащие к ним, образуют концентрические распределения вероятностей расположения электрона, более или менее подобные слоям в луковице. И последняя (да!) важная вещь это то, что орбитали водорода в каждой оболочке имеют в точности одну и ту же энергию. Это очень замечательное свойство и, как можно проследить, именно «красивый» характер взаимодействия между электроном и ядром привел к тому, что концептуально ошибочные вычисления Бора оказались количественно верными.
Рис. 5.7.Энергетические уровни типичных атомов. Для водорода, имеющего один электрон, все орбитали данного уровня имеют в точности одну и ту же энергию. Для отличных от водорода атомов (как изображено здесь) каждый уровень содержит орбитали с последовательно возрастающей энергией. Во всех случаях p -орбитали впервые появляются во второй оболочке, d -орбитали появляются в третьей оболочке, а f -орбитали в четвертой оболочке. Существуют оболочки более высоких энергий, чем показанные здесь. Каждый ящик представляет орбиталь, которую могут занимать не более двух электронов. Две вставки показывают аналогичные электронные структуры лития (с одним электроном вне сердцевины) и натрия (с одним электроном вне сердцевины).
Теперь я проведу вас от атома водорода сквозь строй атомов других элементов. Нам известен порядок, в котором следует обсуждать эти элементы, поскольку мы знаем их атомные номера и, следовательно, число электронов, которые должны присутствовать в каждом случае. Например, если атомный номер элемента равен 15 (это номер фосфора), то его ядро имеет пятнадцать единиц положительного заряда, и, для достижения электрической нейтральности, каждый атом должен иметь пятнадцать электронов. Основная идея заключается в том, что, с небольшими видоизменениями, которые мы скоро узнаем, электроны этих атомов будут описываться орбиталями и энергиями, подобными тем, которые Шредингер нашел для водорода. Но по ходу этого конструирования атомов мы обнаружим некоторые замечательные вещи.
Читать дальше













