Атомный вес самой бета-частицы практически равен 0. (Точнее, 0,00054, но в данном случае мы можем сократить его до 0.) Так как атомный вес равняется числу положительно заряженных частиц в ядре и так как бета-частица является электроном, а следовательно, обладает единичным отрицательным зарядом, ее атомное число равняется –1. Таким образом, бета-частицу можно обозначить как –1β 0, а процесс выхода как
xQ x+y→ x+1R x+y+ –1β 0(Уравнение 8.2)
Обратите внимание, что в уравнениях 8.1 и 8.2 сумма атомных чисел правой части равняется сумме атомных чисел левой части в соответствии с законом сохранения электрического заряда. То же можно сказать и об атомных весах правой части формулы 8.2 согласно закону сохранения массы. (Пока мы можем пренебречь небольшим изменением массы при ее переходе в энергию.)
Гамма-луч обозначается греческой буквой γ. Гамма-излучение является электромагнитным, следовательно, не имеет ни атомного веса, ни атомного числа. Запись будет выглядеть как 0γ 0. Добавляем следующую формулу:
xQ x+y→ xQ x+y+ 0γ 0. (Уравнение 8.3)
Таким образом, когда атом испускает альфа-частицу, его атомное число уменьшается на 2, а атомный вес — на 4. Когда атом испускает бета-частицу, его атомное число уменьшается на 1, а атомный вес остается неизменным. Когда же атом испускает гамма-луч, его и атомное число, и атомный вес остаются неизменными. Этот закон впервые был сформулирован Содди в 1913 году.
Давайте применим этот закон к атому урана с атомным числом 92 и атомным весом 238, т. е. 92U 238. Слабое радиоактивное излучение урана высокой очистки состоит из альфа-частиц. Испускание альфа-частицы уменьшает атомное число атома урана до 90, т. е. до атомного числа тория, а атомный вес до 234. Запись выглядит так:
92U 238→ 90Th 234+ 2α 4. (Уравнение 8.4)
Атом тория, полученный в результате распада атома урана, несколько отличается от атома тория, содержащегося в руде. Атомное число последнего также равняется 90, однако его атомный вес равен 232, то есть 90Th 232.
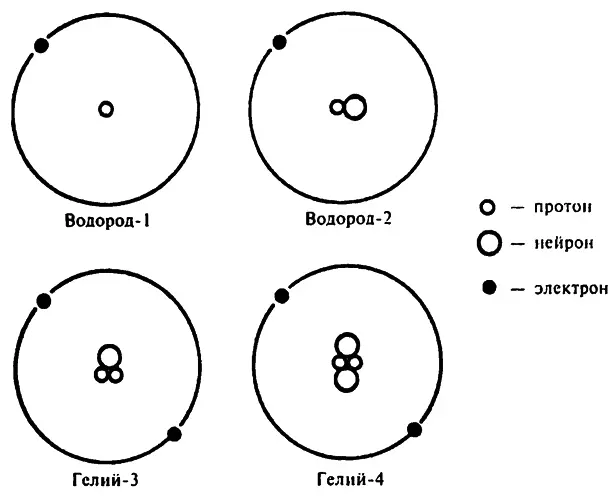
Атомное число и одного и другого атома равно 90, поэтому они оба занимают одну и ту же ячейку периодической таблицы. Содди обнаружил это в 1913 году и предложил называть элементы, имеющие одинаковое атомное число и различающиеся атомным весом, изотопами (от греч., означает «одно и то же место», то есть одно и то же место в периодической таблице).
Так как атомное число изотопов одного и того же элемента одинаково, химики решили на письме отображать лишь их атомные веса: торий–234 и торий–232, или, более кратко, Th 232и Th 234.
С точки зрения химии вполне обоснованно помещать изотопы в одну и ту же ячейку периодической таблицы. Торий–234 и торий–232 имеют в ядре по 90 протонов и соответственно по 90 электронов в нейтральном атоме. Химические свойства элементов определяются распределением электронов по электронным уровням, а значит, химические свойства этих двух изотопов тория, как и изотопов любых других элементов, будут одинаковыми [131] Впрочем, небольшие различия в химических свойствах все же есть. Это особенно характерно для атомов легких элементов, так как один изотоп такого элемента тяжелее другого и поэтому проявляет меньшую активность. Однако эта разница настолько незначительна, что в большинстве случаев ею можно пренебречь.
.
Но, несмотря на то что у атомов изотопов на энергетических уровнях один и тот же набор электронов, они все же отличаются структурой атомных ядер. Количество протонов в ядре изотопов одинаково, значит, неодинаково количество нейтронов. Например, ядро атома тория–234 состоит из 90 протонов и 144 нейтронов, в то время как ядро атома тория–232 состоит из 90 протонов и 142 нейтронов.
Простые изотопы
Когда речь идет об изменениях внутри атомного ядра, например когда мы говорим о радиоактивности (в то время как во время химических преобразований изменяется лишь число электронов, атомное ядро остается неизменным), различия в количестве нейтронов в ядре очень важны.
Итак, процесс распада тория–232 идет очень медленно, именно поэтому этот элемент до сих пор присутствует в земной коре. Атом тория испускает альфа-частицу и его атомное число падает до 88, т. е. до радия. Запишем это:
90Th 234→ 91Pa 234+ 2α 4. (Уравнение 8.5)
С другой стороны, процесс распада атомов тория–234 идет крайне быстро, и именно поэтому в природе этот элемент встречается только в исчезающе малых количествах в урановой руде. Более того, при распаде тория–234 выделяется бета-частица, что приводит к увеличению атомного числа до 91, то есть до протактиния:
Читать дальше













