Но раз олигонуклеотидов у нас много, почему бы не сделать два олигонуклеотида, комплементарные обеим цепям ДНК, по обе стороны от сайта мутации? (Читатели не забыли, что нити ДНК имеют направление, от 5’ – к 3’ – концу, и только в этом направлении полимераза может наращивать цепь? Два таких олигонуклеотида “указывали” бы на возможную мутацию с двух сторон.) И пусть к одному олигу полимераза присоединит дидезоксинуклеотид А, а к другому – дидезоксинуклеотид Т, и мы точно убедимся, что А не заменен на G… не слишком красивая идея, зато простая и осуществимая.
Что может пойти не так? Ну, прежде всего, в образце могут быть обыкновенные свободные нуклеотиды, и ДНК-полимераза, конечно, будет присоединять их, тогда прощай радиоактивный фрагмент определенной длины. Но можно перед анализом обработать образец ферментом – бактериальной щелочной фосфатазой, которая отъест все фосфатные группы от нуклеотидов, и тогда полимеразе не с чем будет работать, кроме тех меченых нуклеотидов, которые добавим мы. Только как ее потом убрать, чтобы она добавленные нуклеотиды не съела? В то время считалось, что щелочную фосфатазу невозможно инактивировать нагреванием, якобы потом она восстанавливает активность (на самом деле инактивировать ее возможно, если не добавлять в раствор цинк, отмечал позднее Кэри Муллис, но хорошо, что я тогда об этом не знал…).
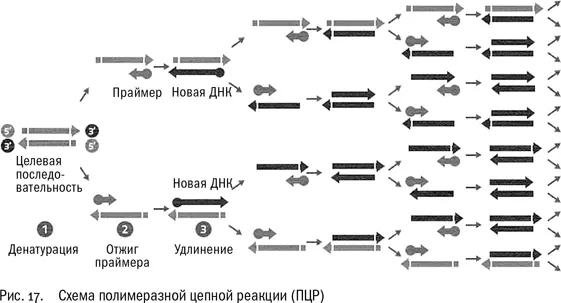
Думаем дальше: а что можно сделать, если не избавляться от обычных нуклеотидов? Пусть полимераза их использует, разрешаем. Пусть она нарастит такие длинные цепочки, какие сможет. А потом слегка нагреем раствор, чтобы двойные цепочки ДНК расплавились и разошлись, и охладим, чтобы к однонитевой ДНК присоединились новые праймеры. Олигов, как мы помним, у нас много, добавим в смесь, сколько не жалко…
Но позвольте, ведь теперь, кроме ДНК образца, у нас появились еще две нити, синтезированные в первой реакции, и каждая из них тоже содержит участок, комплементарный противоположно направленному праймеру. Четыре цепочки ДНК вместо двух изначальных… Стоп! Но это же как раз то самое, что нам было нужно: увеличение концентрации интересующего нас участка ДНК, чтобы он стал заметнее на фоне всей остальной ДНК, которая нас сейчас не интересует.
А если сделать это специально?
А если сделать это не один раз, а два, три, четыре, пять, шесть? И в каждом цикле число нитей ДНК будет удваиваться, как в той сказке про царя, изобретателя шахмат и рисовые зерна на шахматной доске…
Кэри остановил машину, нашел в бардачке ручку и бумагу и начал считать. Если, скажем, раз 30 повторить этот цикл – “добавить к образцу полимеразу, нуклеотиды и праймеры – провести реакцию – расплавить ДНК – провести реакцию” – то образец будет содержать множество копий интересующего нас фрагмента ДНК, а все остальное, ненужное и путающее, станет на его фоне малозначащей примесью.
Дженнифер проснулась и спросила, почему они не едут. Кэри снова тронулся в путь и примерно через милю сообразил, что праймеры необязательно должны быть разделены всего одним нуклеотидом. Черт с ними, с точечными мутациями – таким способом можно получить в достаточном количестве любой фрагмент ДНК!
До изобретения Кэри Муллиса эти фрагменты получали в основном клонированием. Слово “клонирование” вообще означает получение множества копий одного объекта. Клонирование животных – получение генетически идентичных копий особи из ее соматических, то есть неполовых клеток. Клонирование человека – популярный фантастический сюжет, с приматами дело пока не очень ладится (лишь в начале 2018 г., через 22 года после овцы Долли, китайцы опубликовали статью о клонировании детенышей макаки). Клонирование растений широко известно под названием “черенкование”. Клонирование клеток, например лимфоцитов, вырабатывающих антитела, – размножение клеток определенного типа.
Клонированием ДНК называли довольно сложную процедуру – включение нужного фрагмента в кольцевую ДНК (плазмиду), внедрение этой ДНК в кишечную палочку E.coli и выращивание этих кишечных палочек, сначала на чашке Петри, потом в колбе с питательной средой. Бактерии размножаются, копируют плазмиду и вместе с ней наш кусок ДНК; потом плазмиду можно будет выделить, вырезать нужный кусок рестриктазой и отделить его от других с помощью электрофореза. Дело долгое, к тому же культура кишечной палочки пахнет замоченным и протухшим бельем (точнее, наоборот, таз с бельем у нерадивой хозяйки имеет запах этой бактерии). Но ДНК нужна для работы, да и запах привычного человека радует: если так пахнет, значит, культура не загрязнена посторонними микроорганизмами.
Читать дальше
![Елена Клещенко ДНК и её человек [litres] обложка книги](/books/411971/elena-klechenko-dnk-i-ee-chelovek-litres-cover.webp)



![Павел Астахов - ДНК гения [litres]](/books/406456/pavel-astahov-dnk-geniya-litres-thumb.webp)