Но самое главное в действиях водородных связей заключается в том, что только благодаря им вода может находиться в жидком состоянии, а следовательно, что возможна сама жизнь. Не вдаваясь в подробности, кратко скажу, что вода имеет столь высокую температуру кипения (100 °C) только потому, что водородные связи удерживают ее молекулы в компактном состоянии (в жидком состоянии). И если бы не было этих связей, любая молекула воды, имея лишь незначительную тепловую энергию, могла бы испариться, и мы имели бы это вещество только в газообразном состоянии.
Но все это пока что всего лишь интересная информация о водородных связях. А теперь мы рассмотрим те явления, связанные с водородными связями, которые непосредственно оказывают влияние на наше здоровье и которыми мы можем хотя бы в некоторой мере управлять.
Поверхностное натяжение воды
Водородные связи определяют и величину поверхностного натяжения воды, а поэтому по величине этого натяжения мы можем судить, хотя и косвенно, и о величине водородных связей в той же воде. Измеряется же поверхностное натяжение легко и просто. Поэтому в дальнейшем, когда речь будет идти о величине поверхностного натяжения, мы можем считать, что речь идет и о величине водородных связей. А, уменьшая величину водородных связей, мы будем уменьшать величину вязкости то ли воды, то ли крови. Последнее нас больше всего и интересует. Изменять величину водородных связей можно разными способами. Одним из таких способов является температурный режим жидкости. Чем выше температура воды, тем меньше величина водородных связей в воде, и тем меньше поверхностное натяжение воды, и тем меньше вязкость воды.
Таблица 4. Зависимость поверхностного натяжения и вязкости воды от температуры
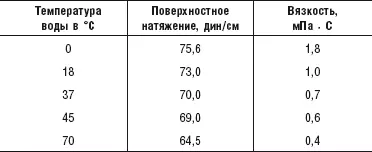
В таблице 4 показано, как зависит поверхностное натяжение и вязкость воды от ее температуры. При повышении температуры воды увеличивается число разорванных водородных связей (в связи с увеличением тепловой энергии молекул воды), а поэтому уменьшаются и поверхностное натяжение воды, и ее вязкость. Но так как повысить температуру тела (и температуру крови) выше 37 °C мы не можем, то ясно, что с помощью температурного фактора мы никак не сможем воздействовать на вязкость крови. Поэтому люди и вынуждены разжижать кровь при помощи всевозможных кислот.
Из таблицы 4 видно, что поверхностное натяжение воды величиной в 69 единиц мы можем получить с помощью нагрева ее до 45 °C, имея при этом определенную величину вязкости. Но точно такой же показатель по вязкости мы можем получить и без нагрева воды, понижая ее поверхностное натяжение до 69 единиц каким-либо иным способом. Например, добавлением в воду этилового спирта. Водка (40 % этилового спирта и 60 % воды) имеет поверхностное натяжение в 30 единиц. Кстати, именно по этой причине она легко и быстро проникает в кровь. Но если нам нужна не водка, а питьевая вода с пониженным поверхностным натяжением, то мы можем добавить в воду лишь незначительное количество этилового спирта (до 2 % – такое количество этого спирта содержит кумыс, речь о котором будет идти в 7-й главе) и получим воду с поверхностным натяжением около 69 единиц. То есть без нагрева воды до 45 °C мы получаем такую же вязкость, как и при этой температуре.
Точно так же мы можем подкислить воду одной из органических кислот и тоже получим и пониженное поверхностное натяжение, и пониженную вязкость такой воды. Как видим, добавлением в воду спирта или органической кислоты мы уменьшаем число водородных связей между молекулами воды, вследствие чего понижается ее вязкость. А если перевести все это на кровь, то точно таким же способом можно понизить и вязкость крови. Именно вязкость крови нас прежде всего и должна интересовать при рассмотрении водородных связей.
Каким же образом этиловый спирт и органические кислоты могут понижать вязкость воды или крови?
Одной из причин разрыва водородных связей является внедрение крупных молекул спирта или кислоты между молекулами воды. Но у кислот имеется еще и другое специфическое свойство – они увеличивают концентрацию ионов водорода в воде, которые и прерывают многие водородные связи между молекулами воды.
Как это происходит?
Ионы водорода, находящиеся в воде, называют гидратированными ионами, так как вода очень энергично взаимодействует с такими ионами. По сути, мы не найдем в воде одиночных ионов водорода. Чаще всего ион водорода связывается с одной молекулой воды, образуя положительно заряженный ион гидроксония (Н 3О +).
Читать дальше
Конец ознакомительного отрывка
Купить книгу













