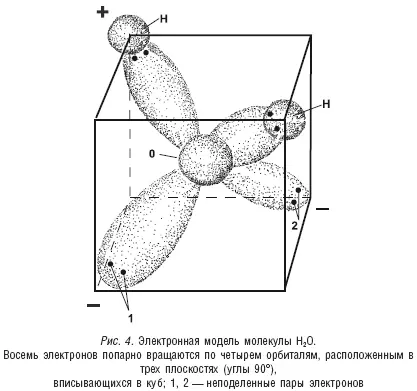
В итоге молекулу воды можно рассматривать как треугольную пирамиду тетраэдрического типа, в вершинах которой размещаются четыре заряда: два положительных и два отрицательных (см. рис. 5).
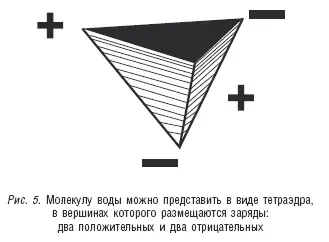
Такое распределение зарядов превращает молекулу воды в диполь. Кроме того, положительный заряд слабо экранированного ядра атома водорода притягивает отрицательный заряд электроотрицательного атома кислорода второй молекулы воды. Это притяжение примерно в 20 раз слабее, чем ковалентная связь, которая удерживает атом водорода около атома кислорода в первой молекуле воды, однако это достаточно сильное взаимодействие между двумя молекулами воды (структура льда построена только на таких связях, но об этом будет сказано ниже). Атом водорода в данном случае служит мостиком между двумя атомами кислорода, причем с одним из них он связан ковалентной связью, а с другим – электростатическими силами взаимодействия. Такая связь называется водородной. И если ковалентные связи мы изображаем прямыми линиями, то водородные – точечными, подчеркивая этим, что они гораздо слабее первых.
Так изображается водородная связь между двумя молекулами воды:
Н – О – Н ··· О <
Молекула воды может иметь четыре водородные связи, но между двумя атомами кислорода всегда находится только один атом водорода.
Жидкости, молекулы которых удерживаются вместе водородными связями, называют ассоциированными (объединенными) жидкостями. К таким жидкостям относится и вода. Водородные связи обусловливают необычайную силу сцепления воды, проявляющуюся и в ее высоком поверхностном натяжении. Высокая температура кипения воды также обусловлена большой энергией, необходимой для разрушения (или для разрыва) водородных связей. Поскольку все эти свойства воды имеют в буквальном смысле слова жизненное значение для растений и животных и поскольку эти свойства зависят от водородных связей, то эти связи можно смело назвать жизненными связями в таком же смысле, как ковалентные связи часто называют просто химическими связями.
Водородные связи образуются лишь с немногими элементами периодической таблицы – с кислородом, фтором, азотом и изредка с хлором. И объясняется это большой разностью между электроотрицательностью водорода и электроотрицательностями указанных выше элементов. Электроотрицательность водорода равна 2,2, что намного меньше электроотрицательности азота (3,0), кислорода (3,4) или фтора (4,0). По этой причине связь между водородом и любым из этих трех элементов обладает довольно высокой полярностью, причем атом водорода всегда находится на положительном конце диполя.
Что это за понятие – электроотрицательность? Электронные пары, обобществляемые двумя различными атомами, не обязательно распределяются между ними поровну, что и было уже показано на молекуле воды. Если один из атомов сильнее притягивает обобществляемые электроны, чем другой, между ними возникает полярная ковалентная связь. Способность атома притягивать к себе электроны, обобществляемые при образовании химической связи, называется его электроотрицательностью.
Водородные связи почти в 20 раз слабее ковалентных, но во много раз сильнее ван-дер-ваальсовых. Впрочем, об этих связях можно говорить и как в меру сильных, и как в меру слабых. Например, на одних только водородных связях построена кристаллическая решетка льда. Все мы знаем, насколько прочен лед. Но стоит немного нагреть лед, как он начнет таять, так как при этом начнут разрушаться водородные связи. Образование льда – это самое наглядное проявление водородных связей. Но эти связи играют чрезвычайно важную роль и в существовании всего живого, они имеются в крови, в белках, в нуклеиновых кислотах и во многих других биополимерах. Например, упорядоченность строения белков не может быть достигнута без участия водородных связей. Белки бывают скручены в спирали, и такую спиралевидную форму обеспечивают водородные связи. В результате нагревания белков (при варке) водородные связи разрываются, и скрученная цепь необратимо теряет свою форму. Водородные связи оказывают влияние и на вязкость крови. При кислой крови величина водородных связей между молекулами воды уменьшается, и кровь (а это в основе своей – вода) становится менее вязкой и, следовательно, более текучей, она легче проникает в микрокапилляры. Такая кровь лучше снабжает клетки нашего организма кислородом. И в быту мы имеем дело с водородными связями; например, при каждой стирке мы пытаемся уменьшить их с помощью поверхностноактивных веществ.
Читать дальше
Конец ознакомительного отрывка
Купить книгу














