Если нагревать какое-нибудь кристаллическое тело, например кусочек олова, то оно расплавится при вполне определённой температуре, характерной для данного вещества. В момент плавления геометрически правильное расположение атомов нарушается.
Телам, относящимся к другой группе, таким как стекло, смола или столярный клей, всегда свойственно беспорядочное размещение атомов. Подобные тела называют аморфными. В отличие от кристаллических они не имеют определённой температуры плавления и затвердевания, при нагреве постепенно размягчаются, утрачивают форму и переходят в жидкое состояние. Поскольку при этом характер расположения атомов в веществе остаётся прежним, то ясно, что аморфные тела не являются истинно твёрдыми, а относятся скорее к переохлаждённым жидкостям.
Характер пространственного расположения атомов как в кристаллических, так и в аморфных телах можно установить с помощью рентгеновских лучей, которые широко применяются для просвечивания человеческого организма.
Кристаллическим веществам свойственно вполне определённое расположение атомов и молекул, которое называют кристаллической решёткой.
Взгляните на рис. 2. На нём изображена кристаллическая решётка поваренной соли. Ионы натрия и хлора, из которых состоит поваренная соль, размещены как бы по углам кубов, соприкасающихся своими гранями.
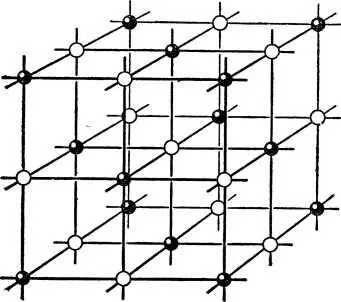
Рис. 2. Расположение ионов в кристалле поваренной соли.
Восемь таких кубиков образуют элементарную ячейку поваренной соли. Множество элементарных ячеек в совокупности даёт кристаллическую решётку.
Один и тот же химический элемент может образовать разные вещества с различными формами кристаллических решёток. При этом такие вещества, имея одинаковый химический состав, нередко обладают совершенно противоположными свойствами. Так, например, алмаз и графит состоят из атомов углерода, но характер расположения атомов в этих веществах различен. Поэтому они по своим физическим свойствам совсем непохожи друг на друга. Графит мягок, имеет чёрную матовую окраску. Алмаз же прозрачен и так твёрд, что им режут стекло.
Кристаллические тела бывают двух видов. Одни из них, имеющие от природы форму многогранников — кубов, пирамид и т. п., — получили название монокристаллов (или просто кристаллов). Другие кристаллические тела не имеют многогранной формы, но если рассмотреть их под микроскопом, то можно заметить, что они состоят из множества мелких, сросшихся между собой монокристаликов. Такие тела называют поликристаллическими.
Большинство горных пород, а также все металлы, относятся к поликристаллическим телам.
Размеры монокристаллов бывают различными. У поваренной соли и сахарного песка кристаллы не больше булавочной головки, кристаллы кварца по величине иногда достигают человеческого роста (рис. 3).

Рис. 3. Такой величины достигают кристаллы кварца.
Распространённость кристаллических веществ в природе чрезвычайно широка. Драгоценный изумруд и обыкновенная слюда, огромные глыбы льда и крошечные снежинки относятся к миру кристаллов. Лишь очень немногие твёрдые тела имеют аморфную структуру, но и они с течением времени обычно начинают кристаллизоваться.
Так, можно наблюдать помутнение стекла. Это происходит в результате образования в стекле кристаликов.
Если сравнить между собой кристаллы разных веществ, то легко заметить, что их форма различна. Например, кристалл поваренной соли имеет форму куба (рис. 4, а ). Кварц кристаллизуется в виде заострённых на концах шестигранных призм (рис. 4, б ).
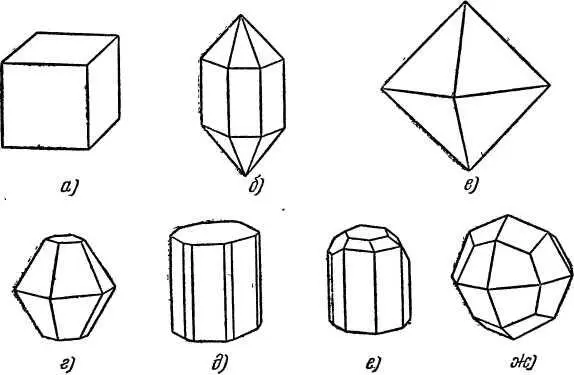
Рис. 4. Различные формы кристаллов: а) поваренная соль, б) горный хрусталь (кварц), в) магнетит, г) корунд, д) берилл, е) топаз, ж) лейцит.
Для сравнения на рис. 4 показаны также кристаллы различных минералов [1] Минерал — химическое соединение, образовавшееся естественным путём.
.
Внешняя форма кристалла зависит от его внутреннего строения — от формы кристаллической решётки и свойств среды, в которой он образуется.
Форма природных кристаллов часто бывает неправильной. Это объясняется тем, что обычно кристаллы развиваются неравномерно, и одни грани вырастают быстрее, а другие медленнее. Однако всем кристаллам одного какого-либо вещества присуще общее свойство: независимо от формы углы между одними и теми же гранями в таких кристаллах строго постоянны. Это свойство кристаллов получило название закона постоянства углов. Закон постоянства углов — один из важнейших законов науки о кристаллах — кристаллографии, основоположником которой является русский учёный Евграф Степанович Фёдоров.
Читать дальше




