Диаграммы: 1 — цветок семейства крестоцветных; 2 — цветок семейства мотыльковых; 3 — накрест-супротивное расположение листьев; 4 — спиральное расположение листьев на стебле с углом расхождения в 120°; 5 — построение диаграммы цветка.
Диагра'мма раствори'мости,графическое изображение зависимости между растворимостью компонента (или компонентов) физико-химической системы и её факторами равновесия (составом, температурой, давлением). См. Растворимости диаграмма .
Диаграмма состав - свойство
Диагра'мма соста'в — сво'йство,графическое изображение зависимости между составом физико-химической системы и численными значениями её физических или механических свойств (электропроводности, твёрдости, вязкости, показателя преломления и др.). Д. с. — с., построенная при постоянной температуре, называется изотермой свойства, при переменной температуре — политермой свойства, при постоянном давлении — изобарой свойства, при переменном давлении — полибарой свойства. См. Двойные системы , Жидкие смеси .
Диагра'мма состоя'ния,диаграмма равновесия, фазовая диаграмма, графическое изображение соотношений между параметрами состояния физико-химической системы (температурой, давлением и др.) и её составом. В простейшем случае, когда система состоит только из одного компонента, Д. с. представляет собой трёхмерную пространственную фигуру, построенную в трёх прямоугольных координатных осях, по которым откладывают температуру ( Т ), давление ( p ) и мольный объём ( v ). Пользование объёмной Д. с. неудобно вследствие её громоздкости; поэтому на практике применяют проекцию Д. с. на одну из координатных плоскостей, обычно на плоскость p — Т .
В качестве простейшего примера на рис. изображена (без соблюдения масштаба) Д. с. двуокиси углерода CO 2. Любая точка Д. с. (фигуративная точка) изображает состояние CO 2при температуре и давлении, отвечающих этой точке. Точка О (тройная точка) отвечает равновесию трёх фаз — твёрдой, жидкой и газообразной CO 2. В точке О пересекаются три кривые: ОА (кривая возгонки), отвечающая равновесиям твёрдой и газообразной CO 2; OK (кривая испарения), отвечающая равновесиям жидкой и газообразной CO 2; ОВ (кривая плавления) — твёрдой и жидкой CO 2. Эти кривые делят плоскость диаграммы на три поля — области существования трёх фаз: твёрдой S, жидкой L и газообразной G . Точка К отвечает критической температуре CO 2(31,0°С), при которой исчезает различие между свойствами жидкости и газа. Согласно терминологии фаз правила , точке О отвечает нонвариантное равновесие, точкам на кривых ОА , ОВ и ОК — моновариантное равновесие, а точкам на полях S , L и G — дивариантное равновесие. В случае полиморфизма Д. с. усложняется (число тройных точек равно числу полиморфных превращений). О Д. с. систем, число компонентов которых больше 1, см. в статье Двойные системы .
Экспериментальное построение Д. с. осуществляется различными методами физико-химического анализа, термических и рентгенографических анализов, оптической и электронной микроскопии, дилатометрии, измерения электросопротивления, твёрдости и др. свойств. Правильность построения Д. с. проверяется на основании правила фаз, принципа соответствия и принципа непрерывности. Д. с. широко применяют на практике в металловедении, металлургии, химии и др.; например, Д. с. железо — углерод имеет важное значение для термической обработки стали.
Лит.: Аносов В. Я., Погодин С. А., Основные начала физико-химического анализа, М.—Л., 1947; Аносов В. Я., Краткое введение в физико-химический анализ, М., 1959; Древинг В. П., Калашников Я. А., Правило фаз с изложением основ термодинамики, 2 изд., М., 1964.
С. А. Погодин.
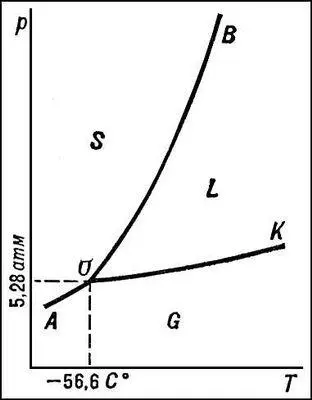
Диаграмма состояния двуокиси углерода CO 2.
Диагра'мма хими'ческая,физико-химическая диаграмма, графическое изображение зависимости между численными значениями физических или механических свойств физико-химической системы и её факторами равновесия (составом, температурой, давлением). Примером простейших Д. х. являются диаграммы состояния и диаграммы состав — свойство двойных систем . Число и взаимное расположение геометрических образов Д. х. — точек, линий, поверхностей, объёмов — позволяет делать выводы о химической природе, составе и границах существования фаз , образуемых компонентами системы, не выделяя и не анализируя этих фаз (см. Физико-химический анализ ).
Читать дальше


