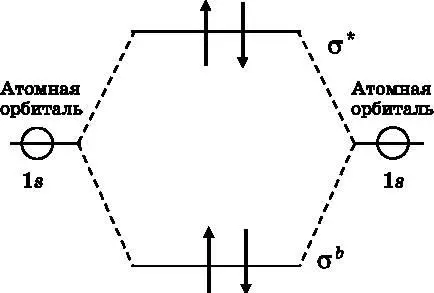
Рис. 12.8. Диаграмма МО гипотетической молекулы гелия. Имеется четыре электрона (стрелки), по два от каждого атома гелия. Два из них занимают связывающую МО. Два других в силу принципа Паули отправляются на разрыхляющую МО. В целом уменьшения энергии не происходит, и поэтому связь не возникает
Чтобы оценить прогностические возможности простых диаграмм, таких как изображённые на рис. 12.7 и 12.8, рассмотрим четыре возможные молекулы. Это молекулярный ион водорода H 2 +, молекула водорода H 2, молекулярный ион гелия He 2 +и молекула He 2. Молекулярный ион H 2 +состоит из двух ядер водорода (протонов) и одного электрона. Подобно одноатомному катиону Na +, он является положительно заряженным, поскольку электронов у него на один меньше, чем протонов. He 2 +— это молекулярный ион, состоящий из двух ядер гелия (по два протона в каждом) и трёх электронов. Таким образом, в нём имеется четыре положительно заряженных частицы (четыре протона) и три отрицательно заряженных электрона.
На рис. 12.9 представлена диаграмма энергетических уровней МО для этих четырёх молекул. Атомные энергетические уровни опущены. Молекулярный ион H 2 +имеет только один электрон, так что он занимает самый нижний энергетический уровень — связывающую МО. Энергия получается ниже, чем у разделённых атомов, но лишь на величину, примерно вдвое меньшую, чем у молекулы H 2, которая имеет два электрона на связывающей МО. Молекула H 2обладает полной ковалентной связью. Говорят, что она имеет порядок связи, равный 1. Молекулярный ион H 2 +имеет порядок связи, равный ½.
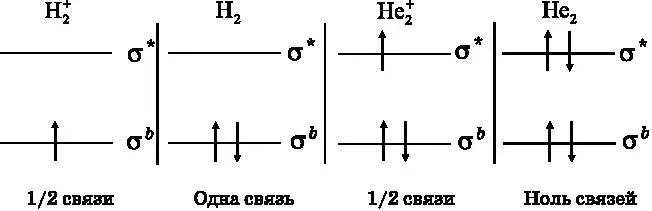
Рис. 12.9. Диаграмма энергетических уровней МО для четырёх молекул: молекулярного иона водорода H 2 + , молекулы водорода H 2 , молекулярного иона гелия He 2 + и молекулы He 2
Молекулярный ион He 2 +имеет три электрона. Первые два из них находятся на связывающей МО, но в силу принципа Паули третий электрон должен размещаться на разрыхляющей МО. Два электрона понижают энергию относительно раздельных атомов, но третий электрон повышает эту энергию. В целом имеет место уменьшение энергии. Молекулярный ион He 2 +существует в природе и имеет порядок связи, равный ½. Как уже говорилось, молекула He 2имеет два связывающих электрона и два разрыхляющих электрона. Связь не возникает, то есть порядок связи равен нулю. Молекулы He 2не существует.
В табл. 12.1 содержится количественная информация об этих четырёх молекулах. В ней приводятся число связывающих электронов, число разрыхляющих электронов и итоговый результат, равный разности числа связывающих электронов и числа разрыхляющих. В таблице также приводится порядок связи. Последние две колонки особенно интересны.
Таблица 12.1. Свойства молекулярного иона водорода H 2 + , молекулы водорода H 2 , молекулярного иона гелия He 2 + и молекулы He 2
Связ. электроны, Разр. электроны, Разность, Порядок связи, Длина связи, Энергия связи
H 2: 2; 0; 2; 1; 0,74Å; 7,2∙10 −19 Дж
H 2 +: 1; 0; 1; ½; 1,06Å; 4,2∙10 −19 Дж
He 2 +: 2; 1; 1; ½; 1,08Å; 5,4∙10 −19 Дж
He 2: 2; 2; 0; 0; Нет; Нет
Данные, приведённые в табл. 12.1, — это результаты экспериментальных измерений. Прежде всего, остановимся на длине химической связи. Она выражена в ангстремах (1 Å = 10 −10 м ). Молекулярный ион H 2 +имеет связь порядка ½ и длину химической связи 1,06 Å. Для сравнения отметим, что молекула H 2имеет полноценную связь порядка 1 и длину химической связи 0,74 Å. Дополнительный электрон на связывающей МО в молекуле H 2удерживает атомы крепче и потому теснее. Молекулярный ион He 2 +имеет связь порядка ½ и длину химической связи 1,08 Å, которая лишь незначительно больше, чем у молекулярного иона H 2 +. Конечно, He 2— это не молекула и поэтому не имеет химической связи. В последнем столбце приведена энергия связи в единицах 10 −19 Дж . Интересна относительная сила связи. Молекула H 2со связью порядка 1 имеет существенно бо́льшую энергию связи, чем два молекулярных иона, в которых порядок связи составляет ½. Так простые диаграммы МО позволяют узнать, будет ли существовать связь, и дают информацию о том, насколько сильной она окажется.
В этой главе мы воспользовались представлениями о молекулярных орбиталях для рассмотрения простейших молекул. Обсуждение касалось только атомов, содержащих 1 s -электроны. Все остальные атомы и молекулы содержат больше электронов и больше орбиталей. В следующей главе представленные здесь идеи будут использоваться для анализа двухатомных молекул, включающих более крупные атомы, такие как молекула кислорода O 2и молекула азота N 2. Эти две молекулы являются основными составляющими воздуха, которым мы дышим.
Читать дальше














