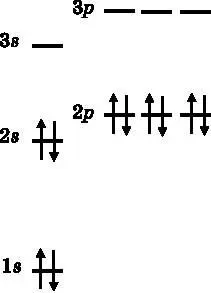Следующим идёт углерод (C, 6) с шестью электронами. Теперь в игру вступает правило Хунда, и мы помещаем шестой электрон на 2 p y-орбиталь, следуя схеме, представленной на рис. 11.3. Следующий элемент — азот (N, 7). Согласно правилу Хунда, седьмой электрон N заселяется на 2 p z-орбиталь, чтобы ни один из электронов на p -орбиталях не был спаренным. Кислород (O, 8) имеет восемь электронов. Восьмой электрон должен быть спаренным, поскольку из первых семи электронов два занимают 1 s -орбиталь, ещё два — 2 s и по одному электрону находится на каждой из 2 p -орбиталей. Чтобы избежать спаривания спинов, надо поместить восьмой электрон на 3 s -орбиталь, которая требует значительно более высокой энергии. Поэтому, как и на рис. 11.3, восьмой электрон заселяется на 2 p x-орбиталь. Фтор (F, 9) обладает девятым электроном, который располагается на 2 p y-орбитали. Наконец, неон (Ne, 10) завершает период n =2 с оболочкой из 10 электронов. Десятый электрон заселяется на 2 p z-орбиталь.
Конфигурации с замкнутыми оболочками
Электронная конфигурация неона изображена на рис. 11.5. Ни один дополнительный электрон не может заселиться на вторую оболочку (орбитали с n =2) без нарушения принципа Паули. Как будет объяснено далее, элементы He, Ne, Ar, Kr и т. п., занимающие последнюю колонку в правой части Периодической таблицы, — особые. Эти элементы называются благородными газами. Все они обладают замкнутыми (заполненными) оболочками, то есть со следующего элемента, имеющего на один электрон больше, начинают заполняться орбитали с квантовым числом n на единицу больше, а значит, обладающие значительно более высокой энергией.
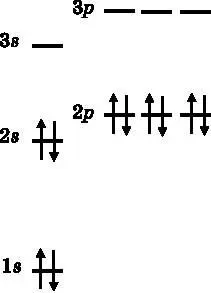
Рис. 11.5. Электронная конфигурация атома неона (Ne, 10). Вторая оболочка заполнена
Атомы стремятся образовывать конфигурации с замкнутыми оболочками
Теперь мы готовы использовать диаграмму энергетических уровней (см. рис. 11.1) и наши три правила расселения электронов по энергетическим уровням для объяснения строения Периодической таблицы и свойств элементов. В следующих главах будет подробно разбираться вопрос о том, что удерживает атомы вместе в составе молекул, однако очень многое можно понять на основе поразительно простого правила: атомы будут захватывать или отдавать электроны, стремясь к ближайшей конфигурации с заполненной оболочкой . Замкнутые электронные оболочки — это электронные конфигурации благородных газов, которые располагаются в правой колонке Периодической таблицы. Конфигурации с замкнутыми оболочками исключительно стабильны. Благородные газы, также называемые инертными, обладают заполненными оболочками и в основном химически инертны. Благородные газы с малыми атомными номерами — гелий, неон и аргон — вообще не образуют химических соединений. Благородные газы с более высокими атомными номерами в особых условиях можно заставить образовать небольшое число соединений. Атомы, отличные от благородных газов, меняются в направлении, приближающем их к образованию устойчивой замкнутой электронной оболочки.
Есть два способа, которыми атом может изменить число своих электронов, чтобы достичь замкнутости электронной оболочки. Первый способ — стать положительным ионом (катионом) или отрицательным ионом (анионом). Атом отдаёт один или больше своих электронов и становится положительно заряженным (катионом) или захватывает дополнительные электроны и становится отрицательно заряженным (анионом). Альтернативный путь для атома состоит в том, чтобы совместно использовать электроны с одним или несколькими другими атомами. Когда два или более атома объединяют электроны, это действует так, как если бы каждый атом обладал необходимыми ему электронами. Тем самым атом с меньшим числом электронов, чем требуется для образования следующий замкнутой электронной оболочки, получает нужное их число, но то же самое происходит и с другими атомами, задействованными в совместном использовании.
Когда атомы совместно используют электроны, чтобы получить такое их число, которое требуется для образования следующей замкнутой оболочки, это совместное использование удерживает атомы вместе. Совместное использование электронов приводит к тому, что энергия соединённых атомов становится ниже энергии отдельных недозаполненных оболочек. Это уменьшение энергии связывает атомы друг с другом. Такой тип химической связи называется ковалентной связью. Ковалентные связи представляют собой основной тип связи в химии. Природа ковалентной связи подробно разбирается в главе 12 на примере простейшей молекулы — водорода, а более сложные молекулы обсуждаются в последующих главах.
Читать дальше