Благоприятные механические, технические и эксплуатационные характеристики кристаллов флюорита в сочетании с прозрачностью в широком спектральном диапазоне, высокой оптической однородностью, отсутствием двойного лучепреломления, люминесценции, высокой радиационной устойчивостью и лучевой прочностью определяют и ряд новых его практических применений в тепловидении и фурье-спектроскопии, астрономии, космической технике, в квантовой и силовой оптике и т. д.
Области практического применения оптического флюорита непрерывно расширяются, в связи с чем энергично возрастают и потребности в этом уникальном оптическом материале.
Свойства флюорита, в том числе и оптические, определяются его конституцией, т. е. химическим составом и кристаллической структурой.
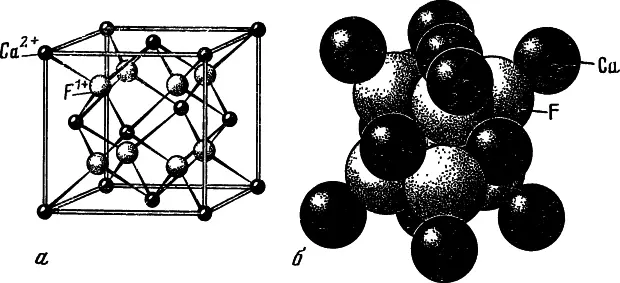
Рис. 4. Различные модели кристаллической структуры флюорита
Объяснение в тексте
Флюорит (по химической номенклатуре — фтористый кальций CaF 2) состоит из атомов кальция (51,33%) и фтора (48,67%), закономерно упакованных по принципу гранецентрированной кубической кристаллической решетки. Это значит, что если мы соединим мысленно все взаимодействующие друг с другом атомы по кратчайшим расстояниям между ними прямыми линиями, то получим регулярную пространственную решетку, которая состоит из бесконечного множества совершенно одинаковых элементарных ячеек, как бы размножающихся в пространстве. Кристаллохимики называют такие ячейки параллелепипедами повторяемости.
Элементарная ячейка флюорита представляет собой куб, разделенный на восемь маленьких кубиков — октантов. Ионы кальция (Ca 2+) располагаются по вершинам большого куба и по центрам каждой из его граней, а ионы фтора (F -) — в центрах каждого октанта. Каждый ион фтора оказывается, таким образом, окруженным четырьмя ионами кальция (FCa 4), располагающимися по вершинам тетраэдра, который называется координационным, а каждый ион кальция находится внутри координационности куба, образованного восемью ионами фтора (CaF 8).
Если изобразить ионы кальция и фтора разноцветными шариками, то элементарная ячейка флюорита будет выглядеть так, как показано на рис. 4, а. На первый взгляд кажется, что в ней слишком много ионов кальция. Но нужно учесть, что каждый ион кальция в вершинах ячейки принадлежит восьми ячейкам, а располагающийся на грани — двум ячейкам. Так что «собственных» ионов кальция здесь всего (1 : 8∙8+1 : 2∙6), ионов фтора — восемь, а число формульных единиц CaF 2в ячейке z — четыре. Если шарики, изображающие ионы, «раздуть» до их истинных размеров, характеризуемых эффективными радиусами (Са 2+= 1,04 Å, F -= l,33 Å), то получим более близкую к реальной, хотя и менее наглядную модель структуры флюорита (см. рис. 4, б). Структуру флюорита можно изобразить также в виде анионных полиэдров — Ca-кубов или катионных F-тетраэдров. Размер ребра элементарной ячейки α 0= 5,46295±0,00010 Å.
Рассмотренная схема кристаллической структуры флюорита является идеальной. Реальная структура несколько сложнее, и это связано прежде всего с тем, что во флюорит, кроме кальция и фтора, в тех или иных количествах входят атомы некоторых других элементов. Ионы F -могут частично замещаться кислородом О 2-, но основные вариации химического состава связаны с изоморфными замещениями Са 2+на Ag +, Cd 2+, Ge 2+, Cu +, Hg 2+, In 3+, Mn 2+, Sn 2+, Sr 2+, Sb 3+, Tl 3+, Pb 4+, Th 4+, U 4+и особенно на двух- и трехвалентные ионы редкоземельных элементов — TR 2+(Sm 2+, Eu 2+, Yb 2+и др.) и TR 3+(Y 3+, Се 3+, La 3+, Lu 3+и др). Элементы-примеси присутствуют во флюорите обычно в незначительных количествах, однако содержание редких земель иногда может достигать десятков процентов. Максимально возможное содержание TRF 3во флюорите, не разрушающее его структуру, 50%. Механизм замещения двухвалентного кальция трехвалентным иттрием или другими редкими землями довольно своеобразный. Ионные радиусы этих элементов близки друг другу (Y 3+= 0,97 Å, Са 2+= 1,04 Å), и при вхождении YF 3в структуру CaF 2иттрий занимает места ионов кальция. При этом две трети ионов фтора заполняют все тетраэдрические позиции, которые им и положено занимать, а одна треть их входит в октаэдрические пустоты между катионами кальция, бывшие в CaF 2незаполненными. В результате такого изоморфизма «с заполнением пространства» плотность и показатель преломления иттрофлюорита по сравнению с флюоритом повышаются, увеличивается параметр элементарной ячейки до α 0= 5,50 Å. При замещении кальция трехвалентными ионами редкоземельных элементов происходит компенсация избыточного заряда эквивалентными количествами ионов О 2-, Na +и других элементов по схемам
Читать дальше













