Все это вызвало большое воодушевление. Особенно вдохновляло то, что теперь, как казалось многим, специалисты наконец получат возможность улучшать функционирование нейронов даже после развития симптомов заболевания. Мы не можем применять этот генетический подход к человеку, но полученные данные побуждают ученых искать лекарства, которые оказывали бы схожее действие и, следовательно, послужили бы средством для борьбы с синдромом ломкой X-хромосомы. Этот синдром — самая распространенная из наследуемых форм умственной отсталости, так что создание реальной методики его лечения принесло бы колоссальную пользу и пациентам, и обществу в целом.
А теперь зайдем с другого конца
Как мы уже отмечали в начале книги, увеличение количества триплетных повторов (их экспансия) на другом конце гена также может вызывать генетические заболевания человека. Наиболее известный пример — миотоническая дистрофия. Ее причиной служит экспансия ЦТГ-повтора в нетранслируемой области на конце гена. Повторы, которые состоят из 35 таких единиц, следующих одна за другой (или из большего их количества), связываются с заболеванием. Чем больше число повторов, тем острее симптомы 15.
Миотоническая дистрофия — пример мутации с приобретением функции. Основное воздействие экспансии в гене ломкой X-хромосомы сводится к остановке выработки его информационной РНК. С миотонической дистрофией дело обстоит иначе. Включается мутантная версия гена миотонической дистрофии, порождающая информационные РНК с обширными зонами экспансии (участками с большим количеством повторов) на конце молекулы. Причина возникновения симптомов — именно эти многочисленные копии триплета ЦУГ в информационной РНК (как мы помним, в РНК основание Т везде заменено на У). Если мы взглянем на рис. 2.6, то увидим, пускай и в схематичном виде, как это происходит. Зоны с увеличенным числом повторов служат как бы молекулярной губкой, впитывающей определенные белки, способные соединяться с этими нуклеотидными последовательностями.
Мусорная ДНК играет существенную роль при миотонической дистрофии. Это показано на рис. 16.4. ЦТГ-экспансия в мусорной нетранслируемой области связывает аномально высокие количества ключевого белка [60] Этот белок называется Muscleblind-like protein 1, или MBNL1 (белок 1, напоминающий белки из семейства muscleblind).
. При нормальных обстоятельствах он участвует в удалении мусорной ДНК, которая обнаруживается между кодирующими белок зонами, когда ДНК впервые копируется в РНК. Поскольку при миотонической дистрофии такое большое количество белка потрачено на связывание с увеличенным количеством нетранслируемых повторов, этот белок не может нормально выполнять свою функцию. А следовательно, множество молекул РНК, вырабатываемых различными генами, не получают должной регуляции.
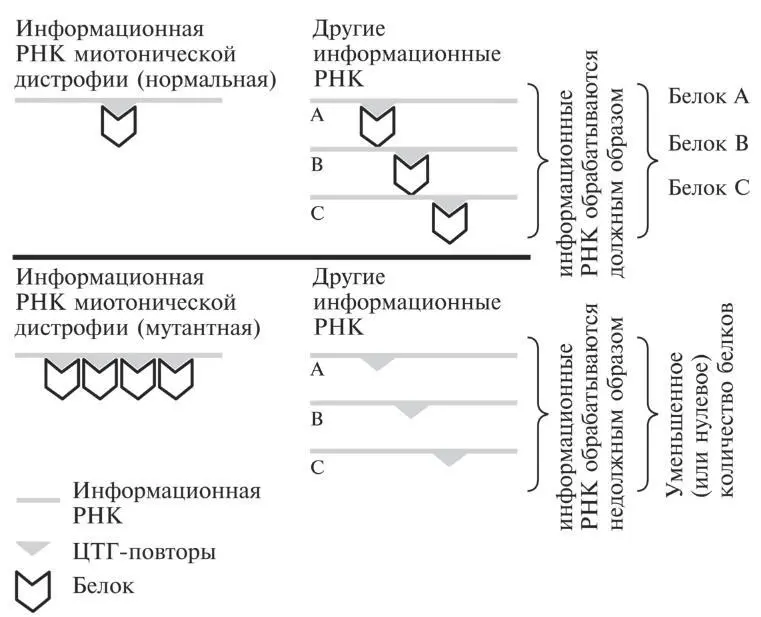
Рис. 16.4.Избыточное связывание белков с увеличенным при миотонической дистрофии количеством повторов определенного триплета в информационной РНК приводит к тому, что белки отбираются от других молекул информационной РНК, которые эти белки должны регулировать (происходит так называемая секвестрация белков). Другие информационные РНК перестают обрабатываться должным образом, что нарушает процесс производства белков, которые они должны помогать синтезировать.
Это своеобразное титрование связывающегося белка, происходящее при многих недомоганиях, когда экспрессируется и такой белок, и ген миотонической дистрофии, очень помогает объяснить, почему одно и то же заболевание подобного рода порой по-разному проявляется у разных пациентов. Здесь не идет речь о ситуации из разряда «все или ничего». Какая-то доля связывающегося белка может оставаться свободной для того, чтобы все-таки регулировать свой ген-мишень. И эта доля может оказаться разной — в зависимости от размеров зоны экспансии и от соотношения количества имеющейся в клетке информационной РНК миотонической дистрофии и связывающегося белка 16.
Не помешает чуть пристальнее рассмотреть те белки, на которые в конечном счете влияет такая нехватка (на рис. 16.4 это условные белки А, В и С). Пока больше всего подтверждений в этом смысле получили инсулиновый рецептор 17, один из сердечных белков 18, а также белок скелетных мышц, служащий переносчиком хлорид-ионов через мембраны 19. Инсулин требуется для поддержания мышечной массы. Если мышечные клетки не экспрессируют достаточно рецептора, связывающего инсулин, мышцы начинают атрофироваться. Сердечный белок, о котором идет речь, играет важную роль в обеспечении нужных электрических характеристик сердца (об этом известно уже сравнительно давно) 20. Перенос хлорид-ионов через мембраны в скелетных мышцах — немаловажная стадия циклов мышечного сокращения и релаксации. Поэтому нарушения в процессах обработки информационных РНК, кодирующих эти белки, вполне согласуются с некоторыми из основных симптомов миотонической дистрофии: увяданием мышц, внезапной летальной остановкой сердца из-за губительных аномалий в сердечном ритме, а также трудностями при расслаблении мышц после их сокращения.
Читать дальше
Конец ознакомительного отрывка
Купить книгу









![Надежда Алданен - Темные Материи [Dark Matters] II Заговор](/books/447032/nadezhda-aldanen-temnye-materii-dark-matters-ii-z-thumb.webp)



