– α-спирали – плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали;
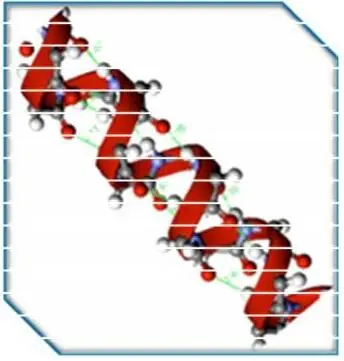
– β-листы (складчатые слои) – несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин;
– π-спирали;
– 310-спирали;
– неупорядоченные фрагменты.
Для всякого белка характерна помимо первичной еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину.
Третичная структура – пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
– ковалентные связи (между двумя остатками цистеина – дисульфидные мостики);
– ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
– водородные связи;
– гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой.
Четвертичная структура (или субъединичная, доменная) – взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Многие белки с особо сложным строением состоят из нескольких полипептидных цепей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка.
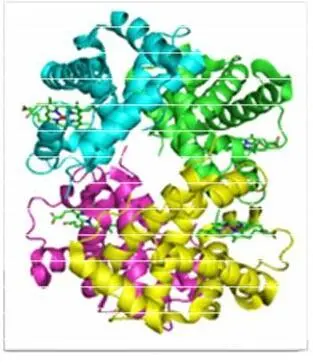
Белки – амфотерные электролиты. При определенном значении pH среды число положительных и отрицательных зарядов в молекуле белка одинаково. Белки имею разнообразное строение. Есть белки нерастворимые в воде, есть белки легко растворимые в воде. Есть белки, имеющие вид нитей, достигающих в длину сотен нанометров; есть белки, имеющие форму шариков диаметром всего 5-7 нм. Они имеют большую молекулярную массу (104-107). Образуют коллоидные растворы, из которых выпадают при увеличении концентрации неорганических солей, добавлении солей тяжелых металлов, органических растворителей или при нагревании (денатурация).
Как правило, белки сохраняют структуру и, следовательно, физико-химические свойства, например, растворимость в условиях, таких как температура и pH, к которым приспособлен данный организм. Изменение этих условий, например, нагревание или обработка белка кислотой или щёлочью, приводит к потере четвертичной, третичной и вторичной структур белка. Потеря белком (или другим биополимером) структуры называется денатурацией. Денатурация может быть полной или частичной, обратимой или необратимой. Самый известный случай необратимой денатурации белка в быту – это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения (преципитации) водорастворимых белков с помощью солей аммония, и используется как способ их очистки. Денатурация – потеря белками их естественных свойств вследствие нарушения пространственной структуры их молекул.
Читать дальше














