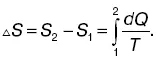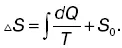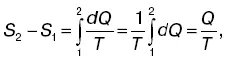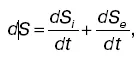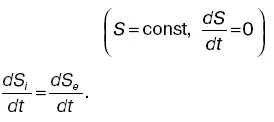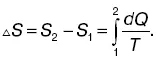
где S 2и S 1– энтропия соответственно в конечном втором и начальном первом состояниях.
Энтропия есть функция состояния системы, разность значений которой для двух состояний равна сумме приведенных количеств теплоты при обратимом переходе системы из одного состояния в другое.
Физический смысл энтропии:
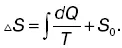
Если система перешла от одного состояния к другому, то независимо от характера процесса изменение энтропии вычисляется по формуле для любого обратимого процесса, происходящего между этими состояниями:
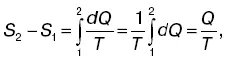
где Q – полное количество теплоты, полученное системой в процессе перехода из первого состояния в состояние второе при постоянной температуре Т. Эту формулу используют при вычислении изменения энтропии в таких процессах, как плавление, парообразование и т. п.
26. Стационарное состояние
Принцип производства энтропии. Организм как открытая система
Выше была описана направленность термодинамических процессов в изолированной системе. Однако реальные процессы и состояния в природе и технике являются неравновесными, а многие системы – открытыми.
Эти процессы и системы рассматриваются в неравновесной термодинамике. Аналогично тому как в равновесной термодинамике особым состоянием является состояние равновесия, так в неравновесной термодинамике особую роль играют стационарные состояния. Несмотря на то что в стационарном состоянии необходимые процессы, протекающие в системе (диффузия, теплопроводность и др.), увеличивают энтропию, энтропия системы не изменяет.
Представим изменением энтропии DS системы в виде суммы двух слагаемых:
DS =DSi + DSl,
где DSi – изменение энтропии, обусловленное необратимыми процессами в системе; DSl – изменение энтропии, вызванное взаимодействием системы с внешними телами (потоки, проходящие через систему). Необратимость процессов приводит к DSi > 0, стационарность состояния – к DSi = 0; следовательно: DSl = DS – DSi < 0. Это означает, что энтропия в продуктах (вещество и энергия), поступающих в систему, меньше энтропии в продуктах, выходящих из системы.
Начальное развитие термодинамики стимулировалось потребностями промышленного производства. На этом этапе (XIX в.) основные достижения заключались в формулировке законов, разработке методов циклов и термодинамических потенциалов применительно к идеализированным процессам.
Биологические объекты являются открытыми термодинамическими системами. Они обмениваются с окружающей средой энергией и веществом. Для организма – стационарной системы – можно записать dS = 0, S = = const, dS i> 0, dSe < 0. Это означает, что большая энтропия должна быть в продуктах выделения, а не в продуктах питания.
При некоторых патологических состояниях энтропия биологической системы может возрастать (dS > 0), это связано с отсутствием стационарности, увеличением неупорядоченности. Формула может быть представлена:
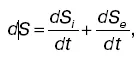
или для стационарного состояния
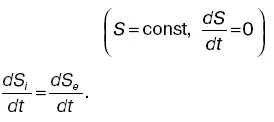
Из этого видно, что при обычном состоянии организма скорость изменения энтропии за счет внутренних процессов равна скорости изменения отрицательной энтропии за счет обмена веществ и энергией с окружающей средой.
27. Термометрия и калориметрия
Точные измерения температур являются неотъемлемой частью научно-исследовательских и технических работ, а также медицинской диагностики.
Методы получения и измерения температур в широком диапазоне весьма различны. Область физики, в которой изучаются методы измерения температуры и связанные с этим вопросы, называют термометрией. Так как температура определяется по значению какой-либо характеристики термометрического вещества, то ее определение состоит в измерении таких физических параметров и свойств, как объем, давление, электрические, механические, оптические, магнитные эффекты и т. п. Разнообразие методов измерения температуры связано с большим количеством термометрических веществ и свойств, используемых при этом.
Читать дальше
Конец ознакомительного отрывка
Купить книгу